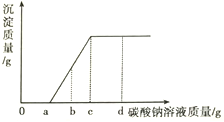
题目内容
【题目】某大型化工厂处理回收含铜废料的生产流程如下:回答下列问题
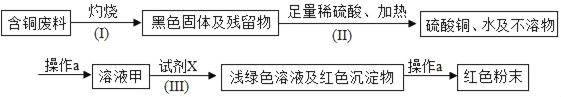
(1)操作a用到玻璃棒,其作用是_____;
(2)流程(Ⅰ)中与铜有关的化学方程式为_____;
(3)流程(Ⅱ)中加入足量稀硫酸的目的是_____;
(4)为达到回收铜的目的,流程(Ⅲ)中加入的试剂X为_____;
(5)工业生产中该流程可能有何缺点?_____。
【答案】过滤 2Cu+O2![]() 2CuO 将氧化铜全部转化成硫酸铜 Fe 红色粉末中混有铁粉,导致铜粉不纯
2CuO 将氧化铜全部转化成硫酸铜 Fe 红色粉末中混有铁粉,导致铜粉不纯
【解析】
由流程图可知:铜和氧气在加热的条件下生成氧化铜,氧化铜和硫酸反应生成硫酸铜和水;不溶性固体与液体分开的方法叫过滤,流程Ⅲ中加入过量的铁粉,铁与硫酸铜反应生成铜和硫酸亚铁;流程中,因为铁粉过量,红色粉末中混有铁粉,导致铜粉不纯。
(1)将固体与液体分离的方法叫过滤;故填:过滤
(2)铜和氧气在加热的条件下生成氧化铜,化学方程式为:2Cu+O2![]() 2CuO;故填:2Cu+O2
2CuO;故填:2Cu+O2![]() 2CuO
2CuO
(3)氧化铜和硫酸反应生成硫酸铜和水,加入过量硫酸是为了将氧化铜全部转化成硫酸铜;故填:将氧化铜全部转化成硫酸铜
(4)流程Ⅲ中加入过量的铁粉,铁与硫酸铜反应生成铜和硫酸亚铁溶液;过滤即可得到铜。故填:Fe
(4)流程中,因为铁粉过量,红色粉末中混有铁粉,导致铜粉不纯。故填:红色粉末中混有铁粉,导致铜粉不纯

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目