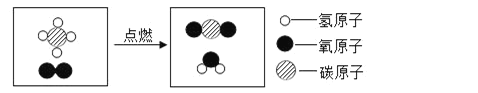
题目内容
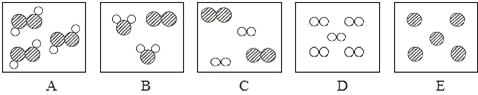
【题目】稀盐酸和氢氧化钾溶液反应时,溶液pH的变化如图所示。下列说法不正确的是
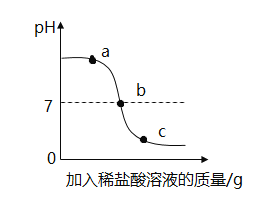
A. a点呈碱性
B. b点到c点之间没有发生酸碱中和反应
C. 该图对应的操作是将稀盐酸滴入氢氧化钾溶液中
D. 等质量等质量分数的稀盐酸和氢氧化钾溶液充分反应后,溶液中所含物质与b点一致
【答案】D
【解析】
A.由图可知, a点溶液的pH大于7,溶液呈碱性,选项正确;
B. 由图可知,该实验是将盐酸加入到氢氧化钾溶液中,到b点,加入的盐酸刚好将氢氧化钾完全反应,b点到c点之间没有发生酸碱中和反应,选项正确;
C. 由图所示,开始,溶液的pH大于7,说明开始容器内放的是氢氧化钾溶液,随酸溶液的加入溶液的pH减少,对应的操作是将稀盐酸滴入氢氧化钾溶液中,选项正确;
D. KOH +HCl == KCl + H2O,由方程式可知氢氧化钾和盐酸的质量比为56:36.5,等质量等质量分数的稀盐酸和氢氧化钾溶液充分反应后,盐酸有剩余,而b点是刚好完全反应,溶液中所含物质不与b点一致,选项错误。
故选D。

练习册系列答案
相关题目