题目内容
【题目】某化学兴趣小组利用以下装置探究气体的制取及性质。结合下图回答有关问题:

(1)图中标号的仪器名称①__________________,②__________________。
(2)若选择氯酸钾制取氧气,该反应的化学方程式为_____________________ 若用装置G收集氧气,氧气应从____________端通入(选填“左”或“右”)。
(3)已知NH3极易溶于水且能与水反应,密度比空气小,实验室可用固体氢氧化钙[Ca(OH)2]
和固体氯化铵(NH4Cl)加热来制取NH3,同时生成氯化钙(CaCl2)和水, 则可选用的发生和收集装置组合是_______________,若用F装置收集NH3,油层的作用是 _________________。
(4)小华通过互联网得知:多种物质都能催化过氧化氢的分解。
【初次探究】实验证明,在过氧化氢溶液中滴加CuSO4溶液能显著加快过氧化氢的分解,如
果要确定CuSO4是催化剂,还必须通过实验确定它在化学反应前后质量和____________不变
【再次探究】CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),稀硫酸中含有三种粒子(H2O、
H+、SO42-)为了进一步探究CuSO4溶液中哪种粒子能起催化作用。小华作了以下分析和设计。
①小华认为最不可能的是H2O,他的理由是 _______________________。
②要说明另外的两种粒子是否起到催化作用,小华设计了如下实验,完成探究活动。
实验步骤 | 实验现象 | 结论 |
a. 取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴稀硫酸 | 溶液几乎没有气泡放出 | 实验证明,起催化作用的是_________ |
b. 另取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴氯化铜溶液 | 溶液中有大量气泡放出 |
【答案】 酒精灯 长颈漏斗 2KClO3![]() 2KCl+3O2↑ 左 AE 防止氨气溶于水,并与水反应而收集不到氨气 化学性质 过氧化氢溶液中含有水 Cu2+
2KCl+3O2↑ 左 AE 防止氨气溶于水,并与水反应而收集不到氨气 化学性质 过氧化氢溶液中含有水 Cu2+
【解析】(1)根据常见仪器解答;(2)根据氯酸钾在二氧化锰的催化并加热的条件下分解生成氯化钾、氧气及氧气的密度比空气大解答;(3)根据反应物的状态、反应条件、生成气体的密度以及是否溶于水解答;根据NH3极易溶于水且能与水反应解答;(4)【初次探究】根据催化剂的定义分析解答;【再次探究】①根据过氧化氢溶液中含有水解答;②根据实验现象分析解答。(1)图中标号的仪器名称①酒精灯,②长颈漏斗;(2) 氯酸钾在二氧化锰的催化并加热的条件下分解生成氯化钾、氧气及氧气,反应的化学方程式为2KClO3 ![]() 2KCl+3O2↑;氧气的密度比空气大,若用装置G收集氧气,氧气应从左端通入;(3)用固体氢氧化钙和固体氯化铵加热来制取NH3,同时生成氯化钙和水,且NH3极易溶于水且能与水反应,密度比空气小,实验室可则可选用的发生和收集装置组合是AE;若用F装置收集NH3,油层的作用是防止氨气溶于水,并与水反应而收集不到氨气;(4)【初次探究】实验证明,在过氧化氢溶液中滴加CuSO4溶液能显著加快过氧化氢的分解,根据催化剂的定义可知,如果要确定CuSO4是催化剂,还必须通过实验确定它在化学反应前后化学性质和质量都没有发生改变;【再次探究】①小红同学认为最不可能的是H2O,他的理由是:过氧化氢溶液中的溶剂是水,因此H2O不能起催化作用;②滴稀硫酸无变化,证明了硫酸根离子不能做催化剂;滴氯化铜溶液时,有大量气泡放出,证明了起催化作用的是铜离子。
2KCl+3O2↑;氧气的密度比空气大,若用装置G收集氧气,氧气应从左端通入;(3)用固体氢氧化钙和固体氯化铵加热来制取NH3,同时生成氯化钙和水,且NH3极易溶于水且能与水反应,密度比空气小,实验室可则可选用的发生和收集装置组合是AE;若用F装置收集NH3,油层的作用是防止氨气溶于水,并与水反应而收集不到氨气;(4)【初次探究】实验证明,在过氧化氢溶液中滴加CuSO4溶液能显著加快过氧化氢的分解,根据催化剂的定义可知,如果要确定CuSO4是催化剂,还必须通过实验确定它在化学反应前后化学性质和质量都没有发生改变;【再次探究】①小红同学认为最不可能的是H2O,他的理由是:过氧化氢溶液中的溶剂是水,因此H2O不能起催化作用;②滴稀硫酸无变化,证明了硫酸根离子不能做催化剂;滴氯化铜溶液时,有大量气泡放出,证明了起催化作用的是铜离子。

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
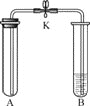
轻松课堂单元测试AB卷系列答案【题目】利用表中装置进行二氧化碳性质的实验,实验前止水夹处于关闭状态。请回答:
实验装置 | 实验1 | 实验2 |
| Ⅰ.将A试管充满CO2,B试管加入紫色石蕊溶液 Ⅱ.密闭下,用针筒将A中部分CO2抽出 Ⅲ.打开K | Ⅰ.将A试管充满CO2,B试管加入稀盐酸 Ⅱ.用针筒向A中注入适量的饱和澄清石灰水,振荡 Ⅲ.打开K |
(1)实验1中可以验证CO2与水发生反应,看到的现象是_______________。
(2)实验2中,步骤Ⅱ中发生反应的化学方程式为________________;步骤Ⅲ中,打开K后发现A中液面上升后又下降,有气泡产生,产生以上现象的原因是_______________