题目内容
【题目】兴趣小组的同学在实验室用碳酸钙和稀盐酸进行二氧化碳获取的探究,请根据题意回答下列问题。
(提出问题)二氧化碳产生的快慢与哪些因素有关?
(猜想假设)假设1:与稀盐酸的浓度有关;
(1)猜想2:_____
(实验和结论)(2)甲同学实验时用普通漏斗(如图A),发现该装置不能用作制取二氧化碳的发生装置,于是他把A装置改装成B,则B中小试管的作用是_____。
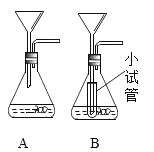
(3)为了准确比较二氧化碳气体的产生速度,请列举一种判断反应快慢的方法_____。
(4)为了验证猜想2,乙同学按下图所示装置进行实验,倾斜锥形瓶,使10mL,稀盐酸与固体充分接触,瓶内气压随时间的变化如曲线图所示。
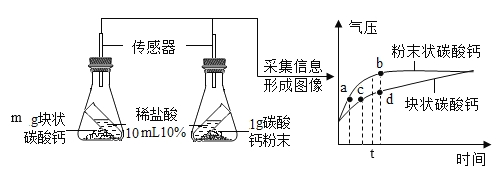
则,图中m数值为_____;图中d点对应的溶液中溶质为(填化学式)_____;形成图像的两条曲线不是从原点开始的原因是_____;乙同学实验的结论是_____。
【答案】碳酸钙的颗粒大小(填石灰石、大理石颗粒大小也给分) 液封,防止气体从漏斗溢出 相同时间收集气体的多少(或收集等体积气体所需时间的多少) 1 HCl和CaCl2(漏填、错填不给分) 锥形瓶内本来就有空气(或不是真空等,合理均可) 相同条件下,碳酸钙的颗粒越小,与稀盐酸产生二氧化碳的速率越快(合理均可)
【解析】
稀盐酸和碳酸钙反应生成氯化钙、水和二氧化碳。
[猜想假设]
(1)物质反应的快慢和反应物的浓度和反应物的接触面积有关,故猜想2:碳酸钙的颗粒大小。
[实验和结论](2)甲同学实验时用普通漏斗,装置不能形成液封,不能用作制取二氧化碳的发生装置,把A装置改装成B,则B中小试管的作用是液封,防止气体从漏斗溢出。
(3)为了准确比较二氧化碳气体的产生速度,判断反应快慢的方法是相同时间收集气体的多少(或收集等体积气体所需时间的多少)。
(4)比较稀盐酸和碳酸钙反应生成二氧化碳的速率,要控制反应物的量相同,故图中m数值为1;图中d点碳酸钙和稀盐酸没有反应完全,对应的溶液中溶质为过量的氯化氢和生成的氯化钙,故化学式为HCl和CaCl2;形成图像的两条曲线不是从原点开始的原因是锥形瓶内本来就有空气;乙同学实验的结论是相同条件下,碳酸钙的颗粒越小,与稀盐酸产生二氧化碳的速率越快。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案