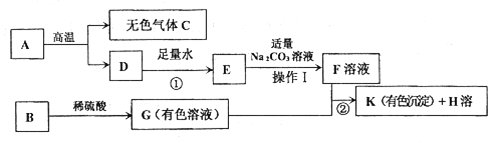
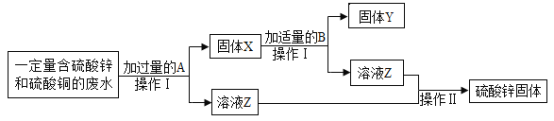
题目内容
【题目】取一定质量的CaCO3固体高温加热一段时间后,冷却,测得剩余固体的质量为8.0g,其中,钙元素质量分数为50.0%.下列判断正确的是( )
A. 生成2.0gCO2气体
B. 原来CaCO3的质量为14.5g
C. 剩余8.0g固体为纯净物
D. 剩余8.0g固体中加入稀盐酸无明显现象
【答案】A
【解析】
根据碳酸钙分解的化学方程式: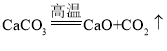 ,结合质量守恒定律可以知道,在反应前后钙元素的质量相等,所以反应后剩余物质中钙元素的质量即为反应前碳酸钙中钙元素的质量,可以据此结合化学方程式进行解答。
,结合质量守恒定律可以知道,在反应前后钙元素的质量相等,所以反应后剩余物质中钙元素的质量即为反应前碳酸钙中钙元素的质量,可以据此结合化学方程式进行解答。
根据题意可以知道钙元素的质量为:8.0g×50.0%=4.0g,碳酸钙中钙元素的质量分数=![]() =40%,所以反应前碳酸钙的质量为:
=40%,所以反应前碳酸钙的质量为:![]() =10.0g,
=10.0g,
根据质量守恒定律可以知道生成二氧化碳的质量为:10.0g﹣8.0g=2.0g;
设生成氧化钙的质量为x,消耗碳酸钙的质量为y
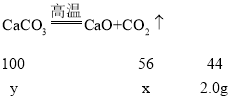
![]()
解得:x=2.55g;y=4.55g
A、根据质量守恒定律可以知道生成二氧化碳的质量为:10.0g﹣8.0g=2.0g;选项A正确;
B、根据上述分析可以知道原来碳酸钙的质量为10g,选项B错误;
C、根据计算可以知道生成氧化钙的质量为2.55g,剩余8.0g固体为氧化钙和碳酸钙的混合物,不是纯净物,选项C错误;
D、根据计算可以知道剩余的碳酸钙的质量为10.0g﹣4.55g=5.45g,加入稀盐酸会产生气泡,选项 D错误。故选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目