题目内容
【题目】为减少污染并变废为宝,某化学小组在实验室探究工业废水的综合利用,设计了以下流程图并完成了回收铜和硫酸锌的实验。
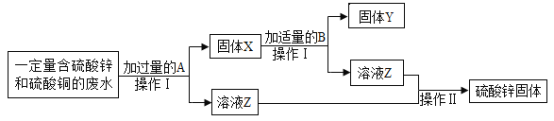
(1)X的成分为_____;操作Ⅰ需用的玻璃仪器有烧杯、玻璃棒和_____。
(2)加入B时反应的化学方程式为_____。
【答案】锌、铜 漏斗 Zn+H2SO4=ZnSO4+H2![]()
【解析】
(1)锌和硫酸铜反应生成硫酸锌和铜,所以加入的A是锌,所以X的成分为锌、铜,操作I分离出了固体和溶液,所以操作是过滤,需用的玻璃仪器有烧杯、玻璃棒和漏斗;故填:锌、铜;漏斗
(2)加入过量的锌可以使硫酸铜完全反应,但是过量的锌对于铜来说仍是杂质,因此加入过量的稀硫酸把锌给反应掉,锌和稀硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2![]() ;故填:Zn+H2SO4=ZnSO4+H2
;故填:Zn+H2SO4=ZnSO4+H2![]()

练习册系列答案
相关题目
【题目】一个密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得数据见下表。下列说法中正确的是(______)
甲 | 乙 | 丙 | 丁 | |
反应前的质量/g | 8 | 35 | 5 | 8 |
反应后的质量/g | 2 | X | 5 | 42 |
A. X=7 B. 在该反应中,甲、乙、丁的化学计量数之比为3:14:17
C.在该反应中,丙物质一定是催化剂 D.该反应的基本反应类型是______