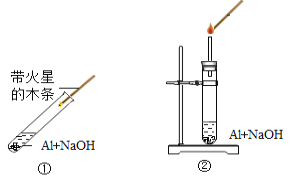
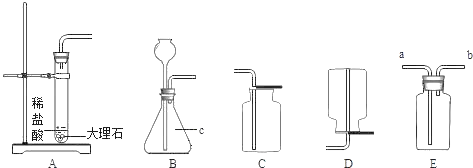
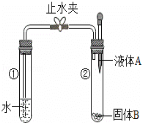
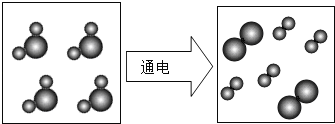
题目内容
【题目】下列框图中的物质均为初中化学常见的物质,其中A是某建筑材料的主要成分,B属于氧化物,下图是它们之间的相互转化关系。回答:
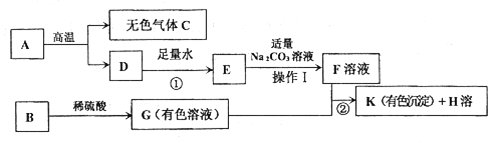
(1)写物质的化学式:A_____;E_____。
(2)得到F溶液的操作I的名称为_____。
(3)写出B→G的化学方程式_____。
(4)若K是蓝色沉淀,反应②的化学方程式为 _____。
【答案】CaCO3 Ca(OH)2 过滤 CuO+H2SO4=CuSO4+H2O CuSO4+2NaOH=====Na2SO4+Cu(OH)2↓
【解析】
;
A是某建筑材料的主要成分高温会分解,所以A是碳酸钙,则无色气体C是二氧化碳,D是氧化钙,D与水反应即氧化钙与水反应生成的E是氢氧化钙,氢氧化钙与适量的碳酸钠溶液反应生成的溶液F的溶质是氢氧化钠,B属于氧化物能与稀硫酸反应生成有色溶液,所以B可能是常见的氧化铁或氧化铜,所以G可能是硫酸铁或硫酸铜,由K是蓝色沉淀可知K是氢氧化铜,则G是硫酸铜,生成的H是硫酸钠。带入整个流程,推断正确。所以:
(1)A是碳酸钙,化学式为CaCO3;E是氢氧化钙,化学式为Ca(OH)2,故填:. CaCO3 Ca(OH)2;
(2)氢氧化钙与适量的碳酸钠溶液反应生成碳酸钙沉淀和溶液F,所以得到F溶液的操作I的名称为过滤,故填:过滤;
(3)B→G可以是氧化铜和稀硫酸的反应,所以化学方程式为:CuO+H2SO4=CuSO4+H2O,故填:CuO+H2SO4=CuSO4+H2O;(也可以是氧化铁与硫酸的反应)
(4)若K是蓝色沉淀,反应②是硫酸铜与氢氧化钠的反应,化学方程式为:CuSO4+2NaOH=====Na2SO4+Cu(OH)2↓,故填:CuSO4+2NaOH=====Na2SO4+Cu(OH)2↓。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】玲玲在学习复分解反应时,对复分解反应的条件产生了兴趣,于是她和小组内的同学仅用以下药品展开了探究活动。
实验药品:稀H2SO4、稀HCl、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、NaCl溶液、酚酞溶液
(提出问题)复分解反应发生的条件是什么?
(查阅资料)硝酸钡溶液显中性,且Ba2+有毒。
(实验探究)玲玲用上述物质做了下列几组实验。
组合序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
组合物质 | H2SO4 NaOH | H2SO4 NaCl | H2SO4 Na2CO3 | H2SO4 Ba(NO3)2 | NaOH Ba(NO3)2 | Na2CO3 Ba(NO3)2 |
(记录和解释)(1)组合①、②、⑤均无明显现象,其中组合_____与另外两组的实质不同。为证明该不同之处,玲玲在实验过程中使用了酚酞溶液。
(2)请写出组合④的化学方程式_____________。
(实验结论)他们请教老师并讨论后知道,只有当两种化合物互相交换成分,生成物中有沉淀或水或气体生成时,复分解反应才可以发生。
(应用)写出利用熟石灰鉴别化肥氯化铵和氯化钾有关反应的化学方程式_______________________。
(拓展延伸)实验结束后,他们将所有废液收集在废液缸中静置,观察到白色沉淀和无色的上层清液。
为了确定沉淀和清液的成分,继续展开探究。
(实验1)探究沉淀的成分。
(提出猜想)Ⅰ.沉淀只有BaSO4 Ⅱ.沉淀只有BaCO3 Ⅲ.沉淀中含有BaSO4和BaCO3。
梅梅取少量沉淀于试管中,滴加过量的______,观察到沉淀部分溶解,证明了猜想Ⅲ是正确的。
(实验2)探究清液的成分。
①取少量清液于试管中,向其中滴加几滴硝酸钡溶液,无明显现象。
②另取少量清液于另一只试管中,滴加几滴______________,有白色沉淀产生。
(解释与结论)探究活动结束后,小组内成员通过讨论分析,一致认为清液中含有的离子除Na+、Cl-外,还有____________________(指示剂除外)。
(处理废液)为了防止污染环境,玲玲向废液缸中加入适量的_________,对废液进行处理后,将固体回收进一步处理,溶液排放。
(交流与反思)根据你对物质溶解性的了解,结合复分解反应发生的条件,请写出一种在水溶液中一般不能发生复分解反应的可溶性盐_____________(写化学式)。