题目内容
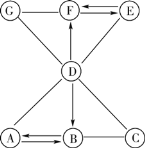
【题目】盐酸是实验室常用的试剂,也是重要的化工原料,茜茜同学归纳出盐酸的五条化学性质(如图1所示,连线表示相互反应);林林同学为表示反应实质绘制了图2。
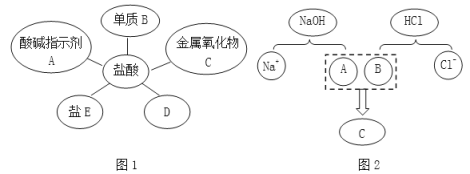
请根据图示回答下列问题。
(1)如图1所示。①若将紫色石蕊溶液滴加到盐酸溶液中,溶液变__________色。
②B不可能是__________(填序号)。 a.Mg b.Fe c.Ag d.Zn
③若C为铁锈,C与盐酸反应的化学方程式是__________。
④D所表示的物质类别是__________。
⑤若E为碳酸钠,D与E反应的化学方程式是__________。
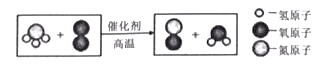
(2)如图2所示。该图描述了氢氧化钠溶液与盐酸反应的微观实质,在图2中,A、B、C处应填入微粒的化学式依次为__________,写出该反应的化学方程式__________。
(3)向稀盐酸中分别逐渐加入下列物质,溶液pH几乎不发生变化的是__________(填序号)。A.AgNO3固体 B.浓盐酸 C.Ca(OH)2固体 D.H2O
(4)完全中和一定量的某盐酸溶液,需要50g 8%的NaOH溶液,若改用50g 8%的KOH溶液,则反应后溶液的pH__________7(填“>”、“=”或“<”)。
【答案】 红 c Fe2O3+6HCl=2FeCl3+3H2O 碱 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH OH-、H+、H2O HCl+NaOH=NaCl+H2O A <
【解析】(1)①石蕊溶液遇酸变为红色;②在金属活动性顺序中Mg 、 Fe、 Zn 都在氢的前面,都可以与酸反应,而Ag 在氢的后面,不能与酸反应,故选c;③铁锈是氧化铁,氧化铁与稀盐酸反应生成氯化铁和水,反应方程式为Fe2O3+6HCl=2FeCl3+3H2O;④酸可以与金属、金属氧化物、碱、盐、酸碱指示剂反应,故D是碱;⑤E是碳酸钠,D是碱,故D是氢氧化钙,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)碱与酸反应的实质是碱中的氢氧根离子与酸中的氢离子反应生成水,故填入微粒的化学式依次为OH-、H+、H2O;氢氧化钠与稀盐酸反应生成氯化钠和水,反应方程式为HCl+NaOH=NaCl+H2O;
(3)A、硝酸银与稀盐酸反应的实质是硝酸银中的银离子与盐酸中的氯离子反应生成氯化银沉淀,而溶于中的氢离子没有参加反应,氢离子的浓度几乎不变,故pH几乎不变,故正确;B、向稀盐酸中加入浓盐酸后,溶液中的溶质的含量增加,故氢离子浓度增加,故pH变小,故错误;C、氢氧化钙中的氢氧根离子与稀盐酸中的氢离子反应生成水使溶液中氢离子的浓度降低,故pH增加,故错误;D、向稀盐酸中加入水,氢离子的浓度降低,故pH增加,故错误。故选A。
(4)氢氧化钠的相对分子质量小于氢氧化钾的相对分子质量,故相同质量的氢氧化钠和氢氧化钾中氢氧根质量的浓度氢氧化钠中多,故用氢氧化钾代替氢氧化钠后与稀盐酸反应,稀盐酸有剩余,故溶液的pH<7。

 阅读快车系列答案
阅读快车系列答案【题目】下列化学用语表达正确,且既有宏观意义,又有微观意义的是
选项 | 内 容 | 化学用语 |
A | 地壳中含量最多的金属元素 | AL |
B | 葡萄糖的化学式 | C6H12O6 |
C | 过氧化氢溶液和二氧化锰混合制氧气 | H2O2 |
D | 氯离子的符号 | Cl1- |
A. A B. B C. C D. D