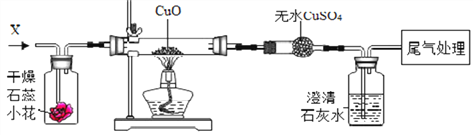
题目内容
【题目】由于符合“低碳出行”的理念,“共享单车”颇受年轻人的喜爱。
(1)“低碳出行”主要减少的环境问题是_______________;
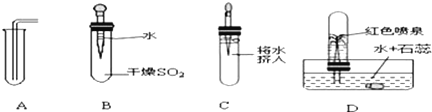
(2)下图所示自行车中的手套柄属于_________材料
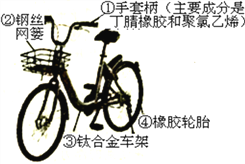
A.金属材料 B.合成材料 C.复合材料
(3)采用钛合金车架的“共享单车”质量轻便,承重强度高。钛原子的结构示意图为 ,其中x=____;
,其中x=____;
工业上冶炼钛的过程如下:
①2FeTiO3+6C+7Cl2![]() 2TiCl4+2FeCl3+6CO
2TiCl4+2FeCl3+6CO
②在氩气环境和高温条件下,利用金属镁和TiCl4反应生成氯化镁和金属钛,该反应的方程式为___________________,基本反应类型为___________反应。
(4)采用实体轮胎的“共享单车”可有效防止爆胎。而普通自行车夏天易爆胎,请用分子的观点解释“夏天易爆胎”的原因_____________________;
(5)钢是铁合金的一种,工业上冶炼所需气体是____________(填化学式,下同),若发现车篓有锈斑,可用厨房中的__________来除。
【答案】 温室效应 B 10 2Mg + TiCl4![]() 2MgCl2 + Ti 置换 分子间间隔变大 O2 CH3COOH
2MgCl2 + Ti 置换 分子间间隔变大 O2 CH3COOH
【解析】(1)根据较高的碳的排放导致温室效应加剧解答;(2)根据丁腈橡胶、聚氯乙烯属于合成材料解答;(3)根据原子中质子数=核外电子数解答;②根据镁和TiCl4在氩气环境和高温条件下反应生成氯化镁和金属钛解答;(4)根据温度升高,分子间间隔变大解答;(5)根据氧气的用途解答;根据醋酸能与氧化铁反应解答。(1)“低碳出行”主要减少的环境问题是温室效应;(2)下图所示自行车中的手套柄属于合成材料,故选B;(3) 根据原子中质子数=核外电子数可得,22=2+8+x+2,x=10;②镁和TiCl4在氩气环境和高温条件下反应生成氯化镁和金属钛,反应的化学方程式为2Mg + TiCl4![]() 2MgCl2 + Ti;该反应符合“一换一”的形式,属于置换反应;(4) 普通自行车夏天易爆胎,的原因是温度升高,分子间间隔变大;(5) 工业上冶炼所需气体是O2,醋酸能与氧化铁反应生成氯化铁和水,故若发现车篓有锈斑,可用厨房中的CH3COOH来除。
2MgCl2 + Ti;该反应符合“一换一”的形式,属于置换反应;(4) 普通自行车夏天易爆胎,的原因是温度升高,分子间间隔变大;(5) 工业上冶炼所需气体是O2,醋酸能与氧化铁反应生成氯化铁和水,故若发现车篓有锈斑,可用厨房中的CH3COOH来除。

 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】化学活动小组围绕磷燃烧的化学反应,展开了如下探究活动:
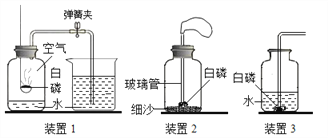
(1)空气中氧气含量的测定
① 表1实验记录
实验目的 | 空气中氧气含量的测量 |
实验装置 | 见装置1 |
现象(证据) | |
实验结论 | 氧气约占空气总体积的五分之一 |
则上表1中的“现象(证据)”栏目应填___________(可多选)。
A. 产生白雾 B. 放出热量 C. 产生五氧化二磷 D. 瓶内水面上升约1/5
② 同学们对该实验进行交流,你认为正确的是___________(可多选)
A. 改用放大镜聚光引燃会更合理
B. 铁丝燃烧产生固体Fe304,用铁丝代替白磷也能达到实验目的
C. 白磷(过量)燃烧熄灭后剩余气体主要是氮气,由此可看出氮气不燃烧,也不支持燃烧
D. 白磷燃烧结束后不能立即打开弹簧夹的原因是怕冷水进入集气瓶使集气瓶破裂
(2)验证质量守恒定律
①乙同学将装置1改装为装置2,为了验证质量守恒定律还需要的仪器是___________。
②调节仪器,称量整个装置的初始质量![]() ,将胶塞上的玻璃管在酒精灯上灼烧,迅速塞紧瓶塞,重新把装置进行称量,质量为
,将胶塞上的玻璃管在酒精灯上灼烧,迅速塞紧瓶塞,重新把装置进行称量,质量为![]() (不考虑气球带来的浮力)。实验结束之后,发现反应后质量减少(
(不考虑气球带来的浮力)。实验结束之后,发现反应后质量减少(![]() ),同学们分析原因如下,你认为正确的是___________(可多选)
),同学们分析原因如下,你认为正确的是___________(可多选)
A. 装置漏气 B. 白磷量不足 C. 气球破损 D. 没冷却到室温就称量
(3)燃烧条件的探究
丙同学用装置3进行燃烧条件的探究(白磷的着火点为40℃)设计了如下实验:
① 实验记录
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验操作 | 将白磷浸入40℃的热水 | 将白磷浸入40℃的热水,通入氧气 | 将白磷浸入冷水 中,通入氧气 |
实验现象 | 白磷不燃烧 | 白磷燃烧 | _______________ |
② 实验分析:对比_________和__________(填实验序号“Ⅰ”“Ⅱ”“Ⅲ”),可知可燃烧物燃烧的条件是温度达到着火点。
(4)探究活动(1)(2)(3)中共同的反应的化学方程式是________________________。