题目内容
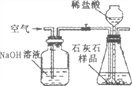
【题目】无水溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:完成下列填空:
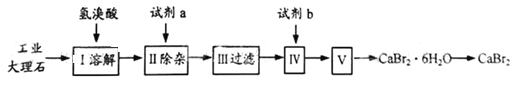
⑴上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸,所需的玻璃仪器有玻璃棒、烧杯、_________ 和________ ;步骤I溶解中发生的化学反应方程式为___________。
⑵已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 _______,控制溶液的pH约为8.0,将Al3+、Fe3+分别转化成沉淀而除去,写出沉淀的化学式________、 __________。
⑶试剂b是_________ ,步骤Ⅳ的目的是 _______________________ 。
⑷步骤Ⅴ所含的操作依次是 _______________ 、____________ 、过滤。
⑸制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入过量Na2CO3溶液,充分反应后过滤;④洗涤、________;⑤称量得到1.88g碳酸钙。
a.请将上述步骤④补充完整,检验碳酸钙沉淀已经洗涤干净的方法是:取最后一次洗涤液,滴加__________溶液,若无白色沉淀产生,则已洗干净。
b.依据测定数据,请计算出样品中溴化钙的质量分数为________。(写出计算过程)。
c.若上述测定溴化钙纯度的实验操作规范,但测定结果偏低,其原因可能是 ________ 。
【答案】 量筒 胶头滴管 CaCO3+2HBr=CaBr2+H2O+CO2↑ Ca(OH)2 Al(OH)3 Fe(OH)3 氢溴酸(或HBr) 除去过量的氢氧化钙 蒸发浓缩 冷却结晶 烘干 CaCl2(或BaCl2) 94% 溴化钙吸水
【解析】(1)配制溶液所需的玻璃仪器有玻璃棒、烧杯、量筒和胶头滴管;步骤I溶解中发生的反应是碳酸钙与氢溴酸反应溴化钙和二氧化碳和水,反应生成的化学反应方程式为CaCO3+2HBr=CaBr2+H2O+CO2↑
(2)为了除去可能过量的氢溴酸,故步骤Ⅱ加入的试剂a是氢氧化钙,化学式为Ca(OH)2 ;Al3+、Fe3+在碱性溶液中分别转化成沉淀的化学式分别为Al(OH)3、Fe(OH)3;
(3)步骤Ⅱ加入的试剂a是氢氧化钙,可能有过剩,故试剂b是氢溴酸;目的是除去过量的氢氧化钙;
⑷步骤Ⅴ所含的操作依次是蒸发浓缩 、冷却结晶 、过滤;
⑸①制得的溴化钙中加入过量的碳酸钠溶液,生成了碳酸钙沉淀。后经过洗涤、烘干称量固体的质量,故填烘干;
a、洗涤是为了除去碳酸钠溶液,故加入氯化钙或氯化钡,若没有沉淀生成,则洗涤干净;
b、1.88g碳酸钙中钙元素的质量为1.88g![]() =0.752g,含0.752g的钙元素的溴化钙的质量为0.752
=0.752g,含0.752g的钙元素的溴化钙的质量为0.752![]() =3.76g,样品中溴化钙的质量分数为
=3.76g,样品中溴化钙的质量分数为![]() =94%;
=94%;
c、溴化钙易吸潮,可能导致测量结果偏小;

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】某同学把干燥、纯净的氯酸钾和二氧化锰的混合物31.5g装入大试管中,加热制取氧气,并在不同时刻测定试管内剩余固体物质的质量(如下表):
反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
剩余固体质量/g | 28.9 | 26.3 | 23.7 | 21.9 | 21.9 |
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气的质量为___________g;
(2)把剩余固体加入足量的水溶解过滤得到滤液55g(二氧化锰难溶于水),计算滤液中溶质的质量分数是多少?(精确到0.1%) ___________