题目内容
不同物质是由不同的微粒构成的.(1)如图是某些物质的微观示意图.
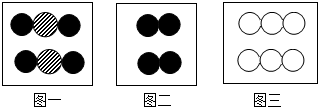
根据上图回答问题:
①图一中涉及
②若图二“
 ”表示的是氮原子,图二代表的含义是
”表示的是氮原子,图二代表的含义是③在三个图形中,能表示单质的可能是
(2)如图给出的是某反应在同一容器中反应前后的分子种类.
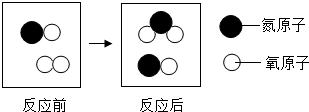
①该化学反应的基本反应类型为
②该化学反应中,参加反应的
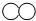 和
和 生成的质量比为
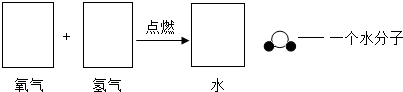
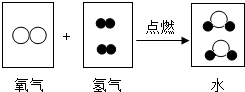
生成的质量比为(3)氢气与氧气在点燃的条件下生成水.请在方框中画出符合这个化学反应的微粒示意图.
分析:(1)①根据元素是原子的总称,由分子构成的原子种类判断组成物质的元素;
②根据原子结合构成分子,构成相同的分子为同种物质的分子,判断图二所表示的意义;
③单质由同种元素组成,因此,单质的分子由同种原子构成或直接由原子构成;
(2)①根据反应中分子构成,判断反应前后物质的种类,并对反应进行分类;
②由分子构成确定物质的化学式,写出反应的化学方程式,计算反应中指定物质的质量比;
(3)根据反应的化学方程式,推断反应的微观示意图,绘制出能表示反应的微观示意图.
②根据原子结合构成分子,构成相同的分子为同种物质的分子,判断图二所表示的意义;
③单质由同种元素组成,因此,单质的分子由同种原子构成或直接由原子构成;
(2)①根据反应中分子构成,判断反应前后物质的种类,并对反应进行分类;
②由分子构成确定物质的化学式,写出反应的化学方程式,计算反应中指定物质的质量比;
(3)根据反应的化学方程式,推断反应的微观示意图,绘制出能表示反应的微观示意图.
解答:解:(1)①图一中的两个分子构成相同,为同种物质的物质,该分子由两种原子构成,则该物质由两种元素组成;
②图二中共有两个构成相同的分子,该分子由两个N原子构成;
③图一中物质的分子是由不同种原子构成的化合物的分子;图二所表示的物质的分子由同种原子构成的单质的分子;图三为由同种原子直接构成的单质;
(2)①对比反应前后的分子,可得出该反应为NO和O2反应生成NO2,因此反应属于化合反应;
②图示为NO和O2反应生成NO2,该反应的化学方程式为2NO+O2═2NO2;反应中O2与NO2的质量比=32:(2×46)=8:23;
(3)氢气在氧气中燃烧生成水的化学方程式为2H2+O2
2H2O,可知反应为2个氢分子与1个氧分子反应生成2个水分子,每个氢分子由两个氢原子构成,每个氧分子由两个氧原子构成,每个水分子由两个氢原子和一个氧原子构成;
故答案为:
(1)①两;②2个氮气分子,每个氮气分子由2个氮原子构成;③图二、图三;
(2)①化合反应;②8:23;
(3)
②图二中共有两个构成相同的分子,该分子由两个N原子构成;
③图一中物质的分子是由不同种原子构成的化合物的分子;图二所表示的物质的分子由同种原子构成的单质的分子;图三为由同种原子直接构成的单质;
(2)①对比反应前后的分子,可得出该反应为NO和O2反应生成NO2,因此反应属于化合反应;
②图示为NO和O2反应生成NO2,该反应的化学方程式为2NO+O2═2NO2;反应中O2与NO2的质量比=32:(2×46)=8:23;
(3)氢气在氧气中燃烧生成水的化学方程式为2H2+O2
| ||
故答案为:
(1)①两;②2个氮气分子,每个氮气分子由2个氮原子构成;③图二、图三;
(2)①化合反应;②8:23;
(3)

点评:分子由原子构成,构成相同的分子为同种物质的分子,同种原子构成的分子为单质的分子,不同种原子构成的分子为化合物的分子.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下表是氯化钠和硝酸钾在不同温度下的溶解度数据,根据数据回答问题.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g/100g水) | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(2)从NaCl的饱和溶液中提取NaCl,应采用的方法是______(填序号).
Ⅰ.冷却结晶Ⅱ.蒸发溶剂Ⅲ.过滤
(3)20℃时,把17克氯化钠和17克硝酸钾分别放入50克水中,能形成饱和溶液的是______(填“NaCl”或“KNO3”),其饱和溶液的质量是______克.为使其变为不饱和溶液,可采用的一种方法是______.
(4)根据数据分析,氯化钠和硝酸钾的溶解度相等的温度范围是______(填序号).
I.0℃~20℃Ⅱ.20℃~40℃Ⅲ.40℃~60℃Ⅳ. 60℃~80℃
(5)将硝酸钾和氯化钠的热混合溶液(两者均己达到饱和)冷却至室温(20℃),析出的晶体是______.
为了研究锌和铝与盐酸反应的不同,某研究小组进行了如下探究。
(1)小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸。写出锌与盐酸反应的化学方程式: 。
(2)小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是
。
(3)小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。
【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么?
【查阅文献】铝在颗粒较小时为灰黑色;AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
【提出合理假设】假设a:该灰黑色沉淀可能含有 ;
假设b:该灰黑色沉淀可能含有AlCl3;
假设c:该灰黑色沉淀可能含有难溶于酸的物质。
【设计并完成实验】取灰黑色沉淀分别进行如下实验。
| 实验编号 | 实验操作 | 实验现象 |
| ① | 加入适量稀盐酸 | 有微量气泡,固体全部溶解,得到澄清溶液 |
| ② | 加入适量蒸馏水 | 固体部分溶解 |
| ③ | 加入适量无水乙醇 | 固体部分溶解 |
【得出结论】由实验①可判断假设c (填“成立”或“不成立”),再结合②和③可得出该灰黑色沉淀的成分是 。
下表是氯化钠和硝酸钾在不同温度下的溶解度数据,根据数据回答问题.
(1)由数据知,氯化钠属于 (填易溶、可溶、微溶或难溶)物质.溶解度受温度影响变化比较大的物质是 (填“NaCl”或“KNO3”).
(2)从NaCl的饱和溶液中提取NaCl,应采用的方法是 (填序号).
Ⅰ.冷却结晶Ⅱ.蒸发溶剂Ⅲ.过滤
(3)20℃时,把17克氯化钠和17克硝酸钾分别放入50克水中,能形成饱和溶液的是 (填“NaCl”或“KNO3”),其饱和溶液的质量是 克.为使其变为不饱和溶液,可采用的一种方法是 .
(4)根据数据分析,氯化钠和硝酸钾的溶解度相等的温度范围是 (填序号).
I.0℃~20℃Ⅱ.20℃~40℃Ⅲ.40℃~60℃Ⅳ. 60℃~80℃
(5)将硝酸钾和氯化钠的热混合溶液(两者均己达到饱和)冷却至室温(20℃),析出的晶体是 .
| 温度/℃ | 20 | 40 | 60 | 80 | 100 | ||
| 溶解度 (g/100g水) | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(2)从NaCl的饱和溶液中提取NaCl,应采用的方法是 (填序号).
Ⅰ.冷却结晶Ⅱ.蒸发溶剂Ⅲ.过滤
(3)20℃时,把17克氯化钠和17克硝酸钾分别放入50克水中,能形成饱和溶液的是 (填“NaCl”或“KNO3”),其饱和溶液的质量是 克.为使其变为不饱和溶液,可采用的一种方法是 .
(4)根据数据分析,氯化钠和硝酸钾的溶解度相等的温度范围是 (填序号).
I.0℃~20℃Ⅱ.20℃~40℃Ⅲ.40℃~60℃Ⅳ. 60℃~80℃
(5)将硝酸钾和氯化钠的热混合溶液(两者均己达到饱和)冷却至室温(20℃),析出的晶体是 .