题目内容
为了研究锌和铝与盐酸反应的不同,某研究小组进行了如下探究。
(1)小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸。写出锌与盐酸反应的化学方程式: 。
(2)小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是
。
(3)小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。
【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么?
【查阅文献】铝在颗粒较小时为灰黑色;AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
【提出合理假设】假设a:该灰黑色沉淀可能含有 ;
假设b:该灰黑色沉淀可能含有AlCl3;
假设c:该灰黑色沉淀可能含有难溶于酸的物质。
【设计并完成实验】取灰黑色沉淀分别进行如下实验。
| 实验编号 | 实验操作 | 实验现象 |
| ① | 加入适量稀盐酸 | 有微量气泡,固体全部溶解,得到澄清溶液 |
| ② | 加入适量蒸馏水 | 固体部分溶解 |
| ③ | 加入适量无水乙醇 | 固体部分溶解 |
【得出结论】由实验①可判断假设c (填“成立”或“不成立”),再结合②和③可得出该灰黑色沉淀的成分是 。
(1)Zn+2HCl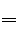
 ZnCl2+H2↑ (2)未去膜的铝片表面有氧化铝(氧化膜),氧化铝先与盐酸反应 (3)铝(或铝和氯化铝) 不成立 铝和氯化铝
ZnCl2+H2↑ (2)未去膜的铝片表面有氧化铝(氧化膜),氧化铝先与盐酸反应 (3)铝(或铝和氯化铝) 不成立 铝和氯化铝

为了研究锌和铝与盐酸反应的不同,某研究小组进行了如下探究。
(1)小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸。写出锌与盐酸反应的化学方程式: 。
(2)小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是
。
(3)小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。
【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么?
【查阅文献】铝在颗粒较小时为灰黑色;AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
【提出合理假设】假设a:该灰黑色沉淀可能含有 ;
假设b:该灰黑色沉淀可能含有AlCl3;
假设c:该灰黑色沉淀可能含有难溶于酸的物质。
【设计并完成实验】取灰黑色沉淀分别进行如下实验。
| 实验编号 | 实验操作 | 实验现象 |
| ① | 加入适量稀盐酸 | 有微量气泡,固体全部溶解,得到澄清溶液 |
| ② | 加入适量蒸馏水 | 固体部分溶解 |
| ③ | 加入适量无水乙醇 | 固体部分溶解 |
【得出结论】由实验①可判断假设c (填“成立”或“不成立”),再结合②和③可得出该灰黑色沉淀的成分是 。