题目内容
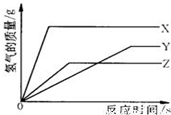
 19、某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z粉末分别与足量的溶质质量分数相同的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况用右图来表示.下列顺序正确的是
19、某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z粉末分别与足量的溶质质量分数相同的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况用右图来表示.下列顺序正确的是( )
分析:“足量稀硫酸”,等质量的三种金属完全反应,放出氢气的质量=$\frac{金属化合价}{金属相对原子质量}×金属质量$;
根据相同时间内放出氢气的多少判断反应速率快慢,再利用反应速率判断金属活动性强弱.
根据相同时间内放出氢气的多少判断反应速率快慢,再利用反应速率判断金属活动性强弱.
解答:解:根据反应情况图,在停止反应前的同一时间,三种金属产生氢气质量从大到小的顺序为X>Z>Y,则金属A的反应速度最快,活动性最大,金属B的反应速度最慢,活动性则最小;
故选X>Z>Y;
三种金属的质量相等、化合价也相同,则产生氢气质量与相对原子质量成反比,所以完全反应后X放出氢气质量最大,其相对原子质量最小;Z产生氢气质量最小,相对原子质量最大;
故选Z>Y>X.
故选AD.
故选X>Z>Y;
三种金属的质量相等、化合价也相同,则产生氢气质量与相对原子质量成反比,所以完全反应后X放出氢气质量最大,其相对原子质量最小;Z产生氢气质量最小,相对原子质量最大;
故选Z>Y>X.
故选AD.
点评:质量相等的金属与足量酸完全反应放出氢气的多少与金属的相对原子质量成反比,与金属的化合价相成正比.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2005?白下区一模)某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如右图所示.下列对该图象理解的叙述中,正确的是( )
(2005?白下区一模)某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如右图所示.下列对该图象理解的叙述中,正确的是( ) (2008?怀柔区二模)某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况用如图来表示.下列对该图象理解的叙述中,正确的是( )
(2008?怀柔区二模)某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况用如图来表示.下列对该图象理解的叙述中,正确的是( )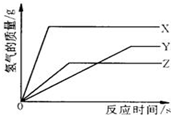 某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验,取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀H2SO4反应,都生成+2价金属的硫酸盐,反应情况如图所示,下列对该图象理解的叙述中,正确的是( )
某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验,取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀H2SO4反应,都生成+2价金属的硫酸盐,反应情况如图所示,下列对该图象理解的叙述中,正确的是( )