题目内容
【题目】核电荷数为1~18的元素的原子结构示意图等信息如下,回答有关问题。
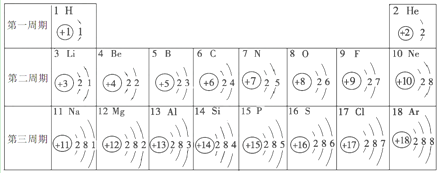
(1)同周期元素的原子结构相同之处是 _________。第三周期元素的原子核外电子排布的变化规律是____________________________。
(2)钠原子最外层电子数为__________,在化学反应中容易 ____(填“得”或“失”)电子,变成_______(写出离子符号)。氯原子最外层电子数为__________,在化学反应中容易____(填“得”或“失”)电子,变成______(写出离子符号)。由此可看出元素的化学性质与其原子的最外层电子数关系密切。
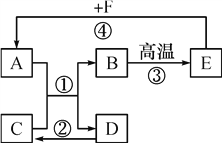
(3)钙元素的原子结构示意图为![]() 。下列元素中与钙元素化学性质相似的是_____(填字母)。
。下列元素中与钙元素化学性质相似的是_____(填字母)。
A.He B.Be C.Mg D.P
【答案】 电子层数相同 从左到右(或随着原子序数的递增),最外层电子数依次增多 1 失 Na+ 7 得 Cl- BC
【解析】(1)根据元素周期数与电子层数的关系;在第三周期中各原子核外电子排布的变化规律是最外层电子数依次增加进行解答;
(2)根据原子结构示意图、最外层电子数与4的大小关系及离子符号的书写规则分析解答;
(3)根据最外层电子数分析解答。
解:(1)同周期元素的原子结构相同之处是:电子层数相同;第三周期元素的原子核外电子排布的变化规律是:从左到右(或随着原子序数的递增),最外层电子数依次增多;
(2)由图可知,钠原子最外层电子数为1,比4小,在化学反应中容易失电子,变成Na+。氯原子最外层电子数为7,比4大,在化学反应中容易得电子,变成Cl-;
(3)元素的化学性质与元素原子的核外电子排布,特别是最外层电子数关系密切。最外层电子数相同,化学性质相似。由钙元素的原子结构示意图可知,最外层电子数为2。由图可知,Be、Mg的原子结构中最外层电子数为2,故选BC。

 考前必练系列答案
考前必练系列答案【题目】同学们应用数字化实验探究外界条件对双氧水分解速率的影响。实验装置如图:
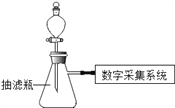
【进行实验】
序号 | 主要实验步骤 | 装置内压强时间图象 |
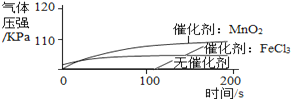
实 验 1 | ①1号抽滤瓶中不加任何试剂, 2号抽滤瓶中加入0.2 g MnO2粉末, 3号抽滤瓶中加入0.2 g FeCl3粉末。 ②用三支分液漏斗分别加入15 mL 4%的H2O2溶液。 |
|
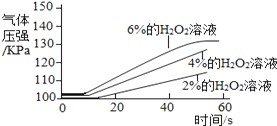
实 验 2 | ①三个抽滤瓶中分别加入0.2 gFeCl3粉末。 ②分别用1号分液漏斗加入15 mL2%的H2O2溶液;用2号分液漏斗加入15 mL4%的H2O2溶液;用3号分液漏斗加入15 mL6%的H2O2溶液。 |
|
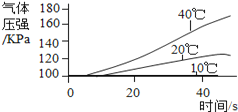
实 验 3 | ①三个抽滤瓶中分别加入0.2 gFeCl3粉末,分别放入装有10℃、20℃、40℃水的水槽中。 ②用三支分液漏斗分别加入15 mL4%的H2O2溶液。 |
|
【解释与结论】
(1)某同学得到“不同催化剂的催化效果不同”的结论,他的依据是_________________________。
(2) 通过上述实验得到:影响该反应速率的外界因素有___________________________________。
【反思与评价】(3)经过多次实验,有的同学对比实验1的3号瓶、实验2的2号瓶中同为40s时的气体压强,发现存在较大的差异,可能的原因是___________________________________________。