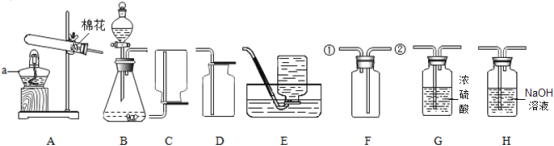
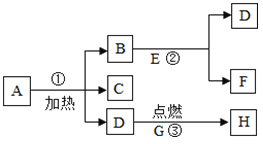
题目内容
【题目】金属的使用及冶炼历史引起了某校化学兴趣小组同学们的极大兴趣,他们进行如下探究:
(1)钛(Ti) 因为具有许多神奇的性能而越来越引起人们的关注,化学兴趣小组的同学们对Mg、Ti、Ag的金属活动性顺序进行探究。
(提出假设)①Ti的金属活动性比Mg强;②Ti的金属活动性介于Mg和Ag之间。
(查阅资料)在相同条件下,活泼金属与酸反应,产生气泡的速率越快,则该金属活动性越强。
(实验设计)一定温度下,取大小相同的Mg、Ti、Ag三种金属薄片,分别投入等质量、等溶质质量分数的足量稀盐酸中,观察现象。
请回答:三种金属薄片加入稀盐酸前都要先用砂纸将表面擦光亮,其目的是_____。
(实验现象)
金属 | Mg | Ti | Ag |
反应现象 | 反应强烈 | 反应缓慢 | 无明显现象 |
(实验结论)假设_____不正确,理由是_____。
(实验反思)用不同溶质质量分数的足量稀盐酸反应,是否也能得出同样结论?_____(填“能”或“不能”),请说明理由:_____。
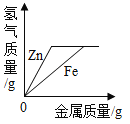
(2)小刚与小红分别做相同质量的不同金属与同溶质质量分数的稀硫酸反应的实验,实验结束后,分别绘制出金属Zn、Fe与稀硫酸反应放出H2的图象(如图所示)。两个图象中存在错误的是_____的图象,理由是_____;他们所绘图象不同的原因是_____。
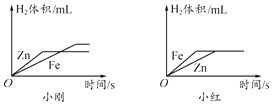
由该实验可以得到的结论:
①金属与酸反应的速率与_____有关。
②质量相同的不同金属分别与足量的酸反应,若生成的盐中金属的化合价相同,则生成氢气的量与_____有关。
【答案】除去氧化膜利于直接反应 ① 镁反应速率比钛快 不能 反应速率与反应物浓度有关 小红 图象中Fe与Zn标反了,Zn的反应速率较Fe快 小刚取的金属量较少,金属反应完,而小红取的酸量较少,酸完全反应完 金属活动性 相对原子质量
【解析】
(1)实验前,三种金属薄片加入稀盐酸前都要先用砂纸将表面擦光亮,其目的是除去氧化膜利于直接反应。根据反应速率越快,金属活动性越强的原则,镁比钛反应强烈,可知①的假设是错误的。而且反应速率与反应物的浓度有关,所以不能用不同溶质质量分数的足量稀盐酸反应来探究金属的活动性强弱。
(2)两个图象中存在有错误的是小红的图象,判断错误的理由是Zn的反应速率较Fe快,因此图象中Fe与Zn标反了。图象不同的原因是:小刚取的金属量较少,金属完全反应,而小红取的酸量较少,酸完全反应。
(3)金属与酸反应的速率与金属活动性有关。
(4)金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与相对原子质量有关。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业酒精中含有甲醇,关于甲醇的下列叙述正确的是( )
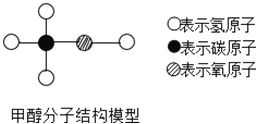
A.甲醇是由1个碳原子、4个氢原子和1个氧原子构成
B.甲醇中碳元素质量分数最大
C.甲醇是由三种元素组成的有机物
D.甲醇的相对分子质量是32克
【题目】甲同学为了区别氢氧化钠和氢氧化钙溶液,设计了如图所示的四组实验方案.

(1)其中能达到实验目的是 .
(2)在C组实验中发生的化学方程式为 .
(3)实验结束后,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有 物质生成(填化学式),滴入酚酞后溶液呈红色.
(4)滴入酚酞后溶液呈红色,说明溶液呈碱性.使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和 三种物质中的一种,或是三种物质两两混合组成的混合物.
(5)为了验证推测,甲同学查阅资料,获悉氯化钡溶液呈中性,并设计如下实验加以验证.请根据要求完成下列空白:
实验内容 | 预测现象 | 结论 |
取少量容器中的上层溶液于试管中,加入过量的氯化钡溶液,静置 | ①若有白色沉淀,溶液呈无色 | 物质是碳酸钠 |
②若无沉淀生成,溶液呈红色 | 物质是氢氧化钙 | |
③若有白色沉淀,溶液呈红色 |
(6)乙同学认为甲同学第②步验证的结论不严密,原因是 .
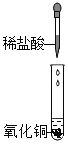
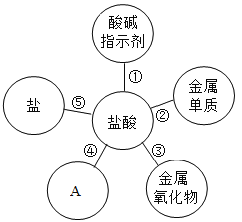
【题目】学习盐酸的化学性质后,小娟做如下实验:
(实验探究)
实验步骤 | 实验操作 | 实验现象 | 结论或解释 |
Ⅰ |
| 黑色固体完全溶解,溶液呈_____色 | 盐酸与氧化铜发生了化学反应 |
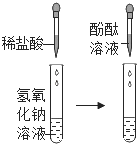
Ⅱ |
| 加入稀盐酸后,未观察到明显现象;滴入酚酞后,溶液变红色 | 盐酸与氢氧化钠未发生化学反应 |
Ⅲ |
将步骤Ⅰ、Ⅱ的废液混合 | 有沉淀生成,溶液仍为红色 | 生成沉淀的原因(用化学方程式解释)_____;所得溶液中溶质的成分_____(酚酞除外) |
(实验反思)
小勇认为小娟实验步骤Ⅱ的结论不正确,理由是_____,于是小娟另取试管重新做了步骤Ⅱ的实验,在滴入酚酞溶液变红色后,继续滴加稀盐酸。边滴边振荡。当观察到_____时,说明盐酸与氢氧化钠发生了反应。从微观角度看,此反应的实质是_____。
实验结束后,小娟将步骤Ⅲ烧杯中的溶液进行了过滤,并向所得溶液中加入_____再倒掉,以防止环境污染。