��Ŀ����
����Ŀ��ij��ѧС��������ϳ���̽������֪�����ȵ�����غ��Ȼ��ƵĻ�������ᴿ���������
�������ᴿ������
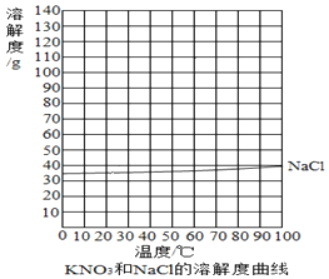
����غ��Ȼ����ڲ�ͬ�¶�ʱ���ܽ��
�¶�/�� | 0 | 20 | 40 | 60 | 80 | 100 | |
�ܽ��/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
��1��20��ʱ��NaCl���ܽ��Ϊ_____�� ��20g NaCl����50gˮ�����Ƴ�_____g NaCl��Һ��
��2�����ݱ������ݣ�����KNO3���ܽ������_____��
��3������KNO3���ܽ�����ߣ�Ԥ��KNO3��70��ʱ���ܽ��ԼΪ_____g��
������ᴿ���裩
��ѡȡ��Ʒ��85gKNO3��5gNaCl�Ļ���
������80��ʱKNO3�ı�����Һ����ˮԼ50mL��ˮ���ܶ�ԼΪ1gmL��1��
�۽�����20��
�ܵõ�����
������ᴿ������
��4��Ϊ��֤�� ���еõ��ľ���Ϊ������KNO3����С��ͬѧ�������֪ʶ���������ϳ�����������·������������Dz�ͬ���ʶ��ܽ�ȵ��Ӱ�켰ʵ�������ˮ�������ʧ��Ӱ�����أ�
����һ ͨ����ѧʵ����м��飬ȡ�������еõ��ľ������Թ��У���ˮ�����Һ���μ�_____���۲�ʵ������û��_____��������NaCl��
������ ��������KNO3���������ԼΪ_____g����ȷ������������еõ�������������бȽϣ�����ȣ���NaCl��
���𰸡�36g 68 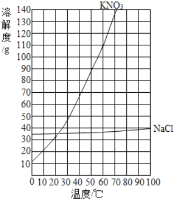 138 ������ ���� 77.2
138 ������ ���� 77.2
��������
��1��ͨ�������ܽ�����߿�֪��20��ʱ��NaCl���ܽ��Ϊ36g����20g NaCl����50gˮ�����Ƴ�68gNaCl��Һ��
��2�����ݱ�����������ڲ�ͬ�¶��µ��ܽ�ȣ��ú������ʾ�¶ȣ��������ʾ���ʵ��ܽ�ȣ��ɻ������ܽ���������£�
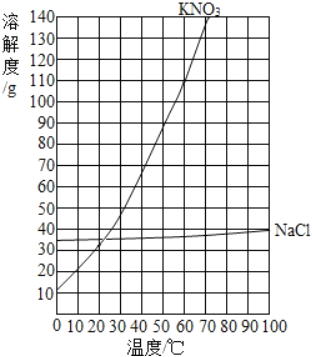
��3������KNO3���ܽ�����ߣ����KNO3��70��ʱ���ܽ��ԼΪ138g��
������ᴿ������
����һ ͨ����ѧʵ����м��飬ȡ������4���еõ��ľ������Թ��У���ˮ�����Һ���μ����������۲�ʵ������û�г�����������NaCl��
������ ��56.2gˮ��20��ʱ�ܽ�������Ϊx
100g��31.6g��56.2g��x
x��![]()
��������KNO3���������ԼΪ77.2g��

����Ŀ��ij�������Ӫ���ɷֱ����(����̼ˮ��������Ҫָ���۵�)��
Ӫ���ɷֱ� |
��Ŀÿ100�� |
���� 1966ǧ�� ������ 7.5�� ֬�� 21.8�� ̼ˮ������ 60.7�� �� 2300���� |
(1)������������ָ_____(����ĸ���)��
A ����B ���� C Ԫ��D ����
(2)�÷������к���Ӫ������_____�֡�
(3)��������ʹ�õ�ʳ�ο����Ǽӵ��Σ�������ȱ����ܻ��еļ�����_____(������״���״�����������������)��
(4)������ͨ�����þ��������ϴ���װ�������������������ɫ��Ⱦ������������_____���ϡ�
(5)�й�������ʳָ�Ͻ���ÿ��ʳ��ʳ��ʯ����6�ˣ�����С��ij�����100�˸÷����棬�൱�ڳ���ʳ��_____�ˡ�(����С�����һλ)
����Ŀ����ͼ��ij����Ƭ�İ�װ�������汻һ�������ùĹĵġ�ij��ѧ��ȤС��ͬѧ�����������������Ȥ�������С��ͬѧһ��Ը��������̽����

��������⣩�������������ʲô�أ�
���������ϣ���ʳƷ�������Ӵ����ױ����������ܣ�
�����ij�������Է�����
���������裩������Ϊ�������������� ����Ϊ�������ǵ�����
����Ϊ�������Ƕ�����̼�� ����Ϊ��������������
���������ۣ���
С��ͬѧ��������һ����Ϊ�IJ��벻��ȷ��������_____��
�����䡢���氲ȫ�Ƕȿ��ǣ�_____ͬѧ����Ҳ�����ܡ�
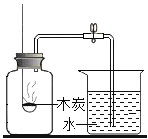
��ʵ����ƣ���Ϊ̽��������룬С��ͬѧ�������ʵ�飬����д�հף�
ʵ�鲽�� | ʵ������ | ʵ����� |
��ע������ȡ���ڵ����壬Ȼ��ע�����ʯ��ˮ�� | �����Ա仯 | ������ȷ |
_____ | ��������ȷ |
����˼��չ����ʵ���С��ͬѧ��Ϊ��ΪʳƷ�ķ����������ѧ���ʲ����ã�����ʳƷ��Ӧ�⣬��Ӧ�߱�ijЩҪ������ΪӦ�þ߱���ЩҪ����һ�㣩_____��
����Ϊ�������װʳƷ�����������⣬������_____���á�
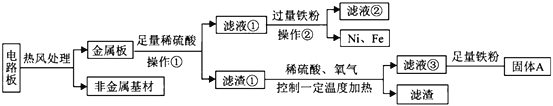
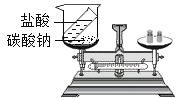
����Ŀ��ͬѧ����Na2CO3��Һ��ŨHCl���о�����������ķ�Ӧԭ��ʱ���Է�Һ�ijɷֽ���̽����
���������裩�����������ʷ�����Ӧ�Ļ�ѧ����ʽΪ��_____���ɴ��Ʋ����Һ��һ����NaCl��������Na2CO3�����ᡣ
��ʵ��̽����
��1��ȷ����Һ���Ƿ������
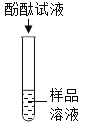
��ѡ���Լ�����������Ļ�ѧ���ʣ�ͬѧ��ѡ������ͼ����ʾ���������ʣ���������X�����ָʾ���е�_____��Һ��
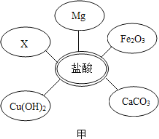
��ʵ����֤��ijͬѧ���Һ�м���������þ�ۣ��۲쵽_____��ȷ����Һ��һ��û�����ᡣ
��2��ȷ����Һ���Ƿ���Na2CO3��ijͬѧѡ��_____�����Һ��pH��l0��
ȷ����Һ��һ������Na2CO3��
��3��������Һ���������ã����ӷ�Һ�еõ�������NaCl�����������ʵ�鷽����ơ�
���� | �����Լ� | ���뷽�� | �������� |
һ | ����Ca��NO3��2��Һ | ���ˡ������ᾧ | �����У������ǣ�_____ |
�� | �Թ�����_____ | _____ | ���� |
��4����չ���ã�
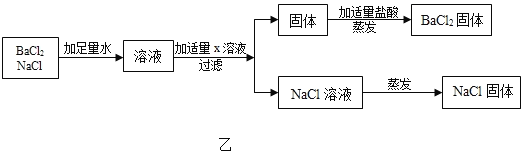
��ͼ�ҷ�������BaCl2��NaCl�Ĺ�������ʱ��X��Һ��������_____��