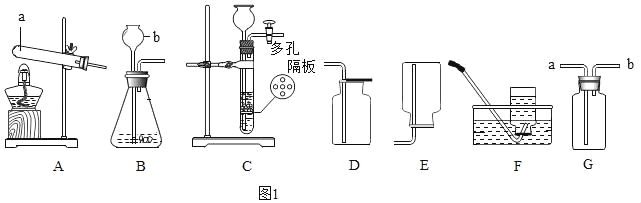
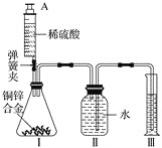
题目内容
【题目】NaOH潮解后极易与空气中的CO2反应生成Na2CO3而变质.为测定实验室一瓶放置已久的烧碱中NaOH含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g.请计算:
(1)反应产生的CO2的质量为___g.
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是_____?
(3)用同浓度的硫酸,与一瓶未变质、部分变质、或全部变质(杂质都是Na2CO3)的烧碱样品反应,需要硫酸的质量都相等.其原因是:__(从钠元素质量守恒的角度解释).
【答案】4.4 78.8% 氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸
【解析】
(1)根据质量守恒定律,反应前后溶液质量的减少就等于反应过程中所生成的气体的质量,所以反应产生的CO2的质量为200g+200g﹣395.6g=4.4g.故填:4.4
(2)根据质量守恒定律,反应物和生成物之间的量的关系,可以解决此题.
故填:78.8%
解:设所取样品中含有Na2CO3的质量为x.
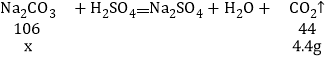
![]() 解得:
解得:![]()
则烧碱样品中NaOH%=![]()
答:烧碱样品中NaOH的百分含量为78.8%.
(3)根据质量守恒定律,氢氧化钠转化成碳酸钠的过程中,钠元素的质量没变,故填:氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,消耗98g硫酸.

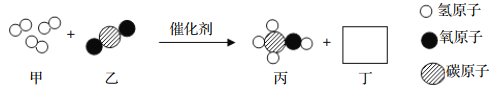
【题目】甲、乙、丙、丁四种物质的转化关系如图所示(“→”表示反应一步实现,部分物质及条件已略去)。下列选项能实现图示转化的是( )
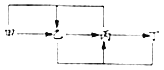
物质选项 | 甲 | 乙 | 丙 | 丁 |
A | C | CO | CO2 | CaCO3 |
B | Na2CO3 | NaOH | NaCl | CuCl2 |
C | Ca( OH)2 | CaCO3 | CO2 | H2CO3 |
D | H2SO4 | H2 | Fe | Fe3O4 |
A. A B. .B C. C D. D