题目内容
【题目】(1)写出工业上以赤铁矿为原料炼铁过程中,一氧化碳与氧化铁发生反应的化学方程式_____;高炉炼出的铁是______物 ( 填“混合”或“纯净” )。
(2)将一定量的锌粉放入稀硫酸、硫酸亚铁、硫酸铜的混合溶液中,充分反应后过滤,向滤渣中加盐酸有气泡产生,则滤液中一定含有的溶质是____(填化学式)。
(3)要验证锌、铜、银三种金属的活动性顺序,只用三种试剂,你选择的一组试剂是____(填化学式)
【答案】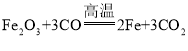 混合 ZnSO4 Zn、Ag、CuCl2或ZnSO4、Cu、AgNO3
混合 ZnSO4 Zn、Ag、CuCl2或ZnSO4、Cu、AgNO3
【解析】
(1)赤铁矿主要成分为氧化铁,一氧化碳与氧化铁在高温条件下反应生成铁和二氧化碳,化学方程式是: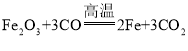 ;高炉炼出的铁中含有碳等物质,因此属于混合物;
;高炉炼出的铁中含有碳等物质,因此属于混合物;
(2)根据金属活动性:锌>铁>氢>铜,将一定量的锌粉放入稀硫酸、硫酸亚铁、硫酸铜的混合溶液中,锌先与硫酸铜反应,生成硫酸锌和铜;硫酸铜反应物后,若还有锌,锌与稀硫酸反应生成硫酸锌和氢气;硫酸反应完后,若还有锌,锌与硫酸亚铁反应生成铁和硫酸锌。而滤渣加入盐酸,有气泡产生,说明硫酸铜、硫酸没有剩余,滤渣中至少含有铁,而锌全部将硫酸铜和硫酸消耗完毕,生成硫酸锌,但硫酸亚铁是否反应完,不能确定,故滤液中一定含有硫酸锌;
(3)金属活动性为:锌>铜>银,要验证该顺序,根据题意要求只能选择三种试剂完成探究,可以选择Zn、Ag、CuCl2,锌可与氯化铜反应生成铜和氯化锌,看到有红色固体析出,证明锌>铜,而银与氯化铜不能发生反应,没有明显实验现象,证明铜>银,从而得出:锌>铜>银。(也可选择ZnSO4、Cu、AgNO3,合理即可)

 阅读快车系列答案
阅读快车系列答案【题目】归纳与反思是学习化学的重要环节。下列主题知识归纳中完全正确的一组是![]()
A.物质的提纯 | B.日常生活常识 |
除去氯化亚铁溶液中的氯化铜---铁粉 除去HCl气体中少量CO2气体--石灰水 | 食品干燥剂---常用生石灰 医疗上配制生理盐水--常用氯化钠 |
C.性质与用途 | D.发现化学与安全 |
氧气具有助燃性--作燃料 氮气化学性质不活泼--作保护气 | 发现煤气泄漏---立即打开排油烟机 皮肤沾上浓硫酸--涂抹氢氧化钠溶液 |
A.AB.BC.CD.D
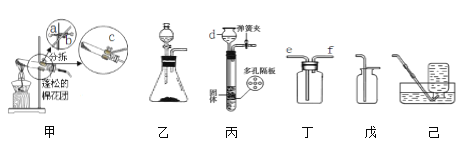
【题目】南南同学看到“好想你”红枣袋中装有一袋防腐剂,品名为“504双吸剂”,其标签如图1所示.南南和北北对这包久置的“504双吸剂”固体样品很好奇,设计如下实验进行探究.
(提出问题)久置固体的成分是什么?
(查阅资料)铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
(实验探究)
南南同学的方案:
实验操作 | 实验现象 | 实验结论 |
取少量固体放于试管中,滴加足量的_____. | 固体逐渐消失,有无色气体产生,得到浅绿色溶液. | 固体中一定含有_____, 一定不含Fe2O3. |
北北同学认为南南同学的实验并不能得出一定不含Fe2O3的结论,理由是_____,并设计如图2实验方案继续验证.
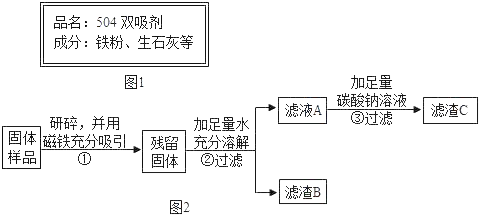
(1)步骤①样品用磁铁吸引前需经过研碎,其中研碎的目的是_____.
(2)步骤②中固体溶解时放出大量热,由此可以判断固体中一定含有_____.写出该过程中的化学方程式_____.
(3)步骤③中反应的化学方程式是_____.
北北同学对滤渣B又进行探究.
实验操作 | 实验现象 | 实验结论 |
①取滤渣B于试管中,加入适量 _____ ②生成的气体通入_____ | ①固体减少,_____ ②该溶液变浑浊. | 固体中一定含有CaCO3 和Fe2O3. |
(实验结论)综合上述实验及所给数据,该久置固体中一定含有的物质是Fe、Fe2O3、CaO、CaCO3.
(实验拓展)为增强双吸剂的吸收效果,常在双吸剂中加入一定量的NaCl,NaCl的作用可能是_____.
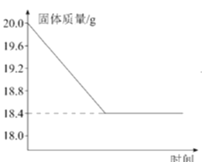
【题目】将氯化钠和氯化铜的固体混合物30g完全溶于109.6 g水中形成溶液,再将100g一定溶质质量分数的氢氧化钠溶液分5次加入到该溶液中,充分反应后,测得的实验数据如下表所示:
实验次数 | 1 | 2 | 3 | 4 | 5 |
加入氢氧化钠溶液质量/g | 20 | 20 | 20 | 20 | 20 |
共生成沉淀的质量/g | 4.9 | 9.8 | m | 19.6 | 19.6 |
求:(1)表中m的值为 。
(2)原混合物中氯化铜的质量为 。
(3)恰好完全反应时,所得溶液的溶质质量分数是多少?(写出计算过程)