题目内容
【题目】我市拥有丰富的海洋资源,开发利用这些宝贵的资源有力地促进了我市经济的发展。
(1)从海水中提取出的粗盐中除了NaCl外,还含有泥沙等杂质。请完善下列实验室中除去泥沙等杂质的实验步骤,并回答相关问题:
![]()
其中操作1的名称是_________,该操作中用到的玻璃仪器有烧杯、玻璃棒 、_________(填仪器名称);在加热蒸发过程中,当蒸发皿中_________时,停止加热。
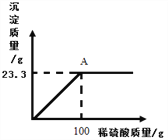
(2)实验结束,小组同学发现溶解的粗盐质量为5.1g,蒸发后精盐质量为5.2g,其原因可能是_________
A.粗盐未充分溶解就过滤 B.蒸发时未用玻璃棒搅拌
C.蒸发后,所得的精盐较潮湿 D.称量精盐时,精盐与砝码放反了
(3)查阅资料得知:海水提取出粗盐后的母液中,还含有较多的氯化镁,用氯化镁可制得金属镁。工业上从母液中提取氯化镁的过程如下:
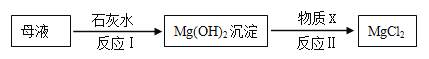
则物质X是_________(填名称)。
(4)工业上可用电解饱和NaCl溶液的方法制得氯气、氢气和一种碱,请写出该碱的化学式_________,你猜想的依据是_________。
【答案】 过滤 漏斗 出现较多量固体 CD 盐酸 NaOH 质量守恒定律
【解析】(1)粗盐提纯的一般步骤是:溶解、过滤、蒸发、计算产率,故操作1 是过滤;过滤时需要的仪器有烧杯、玻璃棒、铁架台和漏斗,其中玻璃仪器有烧杯、玻璃棒 、漏斗;在加热蒸发过程中,要边加热边搅拌,等出现大部分固体时停止加热,利用余热将液体蒸干;(2)A、粗盐未充分溶解就过滤会导致精盐的质量偏小;B、蒸发时未用玻璃棒搅拌会导致液体飞溅,导致精盐的质量偏小;C、蒸发后,所得的精盐较潮湿,那么精盐的质量偏大;D、称量精盐时,精盐与砝码放反了,那么精盐的质量等于砝码的质量减去游码的质量,现称得精盐的质量为5.2g,那么精盐的实际质量更大。故选CD;(3)氢氧化镁能与盐酸反应生成氯化镁,即X是盐酸;(4)饱和NaCl溶液的由溶质氯化钠和溶剂水组成的,根据质量守恒定律化学反应前后元素的种类不变,故电解生成的碱是氢氧化钠。