题目内容
某化学兴趣小组同学在实验室里收集了一些溶质为FeSO4和CuSO4的废液,想从中回收金属铜和硫酸亚铁溶液,设计了如下方案:
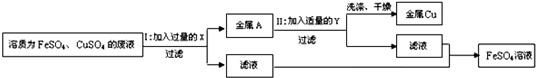
(1)步骤Ⅰ中有关反应的化学方程式是
(2)步骤Ⅱ中所加试剂Y的名称为
(3)加入过量X的目的是
(4)步骤Ⅰ和Ⅱ中都有过滤操作,所需要的玻璃仪器有
(5)步骤Ⅱ中经过过滤、洗涤、干燥可以得到纯净的金属铜,洗涤时检验金属铜是否已洗净的方法是

(1)步骤Ⅰ中有关反应的化学方程式是
Fe+CuSO4═Cu+FeSO4
Fe+CuSO4═Cu+FeSO4
.(2)步骤Ⅱ中所加试剂Y的名称为
稀硫酸
稀硫酸
.(3)加入过量X的目的是
使CuSO4完全转化为FeSO4
使CuSO4完全转化为FeSO4
.(4)步骤Ⅰ和Ⅱ中都有过滤操作,所需要的玻璃仪器有
漏斗
漏斗
、烧杯
烧杯
和玻璃棒
玻璃棒
.(5)步骤Ⅱ中经过过滤、洗涤、干燥可以得到纯净的金属铜,洗涤时检验金属铜是否已洗净的方法是
取最后洗涤液少量,滴加适量氯化钡溶液(或硝酸钡溶液、氢氧化钡溶液),若无沉淀产生,则证明金属铜已洗净
取最后洗涤液少量,滴加适量氯化钡溶液(或硝酸钡溶液、氢氧化钡溶液),若无沉淀产生,则证明金属铜已洗净
.分析:根据题意,要从FeSO4和CuSO4的废液中回收金属铜和硫酸亚铁溶液,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁.为了将过量的铁除掉,步骤Ⅱ中所加试剂为稀硫酸,据此完成有关的分析填空.
解答:解:由题意可知:要从FeSO4和CuSO4的废液中回收金属铜和硫酸亚铁溶液,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁.为了将过量的铁除掉,步骤Ⅱ中所加试剂为稀硫酸.所以:
(1)步骤Ⅰ中的反应是加入的过量的铁与硫酸铜反应生成了硫酸亚铁和铜.反应的方程式是:Fe+CuSO4═Cu+FeSO4;
(2)为了将过量的铁除掉,步骤Ⅱ中所加试剂Y的名称为稀硫酸;
(3)加入过量X的目的是:使CuSO4 完全转化为FeSO4;
(4)步骤Ⅰ和Ⅱ中都有过滤操作,所需要的玻璃仪器有漏斗、烧杯、玻璃棒;
(5)由于铜是从硫酸亚铁的溶液中过滤出来的,不免沾有硫酸亚铁溶液.所以,洗涤时检验金属铜是否已洗净的方法是:取最后洗涤液少量,滴加适量氯化钡溶液(或硝酸钡溶液、氢氧化钡溶液),若无沉淀产生,则证明金属铜已洗净.
故答为:(1)Fe+CuSO4═Cu+FeSO4;(2)稀硫酸;(3)使CuSO4 完全转化为FeSO4;(4)漏斗,烧杯,玻璃棒;(5)取最后洗涤液少量,滴加适量氯化钡溶液(或硝酸钡溶液、氢氧化钡溶液),若无沉淀产生,则证明金属铜已洗净.
(1)步骤Ⅰ中的反应是加入的过量的铁与硫酸铜反应生成了硫酸亚铁和铜.反应的方程式是:Fe+CuSO4═Cu+FeSO4;
(2)为了将过量的铁除掉,步骤Ⅱ中所加试剂Y的名称为稀硫酸;
(3)加入过量X的目的是:使CuSO4 完全转化为FeSO4;
(4)步骤Ⅰ和Ⅱ中都有过滤操作,所需要的玻璃仪器有漏斗、烧杯、玻璃棒;
(5)由于铜是从硫酸亚铁的溶液中过滤出来的,不免沾有硫酸亚铁溶液.所以,洗涤时检验金属铜是否已洗净的方法是:取最后洗涤液少量,滴加适量氯化钡溶液(或硝酸钡溶液、氢氧化钡溶液),若无沉淀产生,则证明金属铜已洗净.
故答为:(1)Fe+CuSO4═Cu+FeSO4;(2)稀硫酸;(3)使CuSO4 完全转化为FeSO4;(4)漏斗,烧杯,玻璃棒;(5)取最后洗涤液少量,滴加适量氯化钡溶液(或硝酸钡溶液、氢氧化钡溶液),若无沉淀产生,则证明金属铜已洗净.
点评:混合物分离要考虑为彻底分开而加入过量试剂,所以后一环节需要将之除去.

练习册系列答案
相关题目
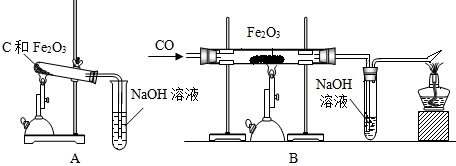
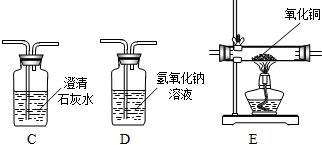
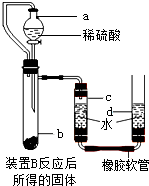
 .
.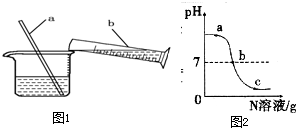 铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.图1是稀释浓硫酸实验的示意图.
铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.图1是稀释浓硫酸实验的示意图. 已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.
已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.