��Ŀ����
����Ŀ��ijУ��ѧ��ȤС��Ϳ����������ĺ�������ʵ��̽����������롣
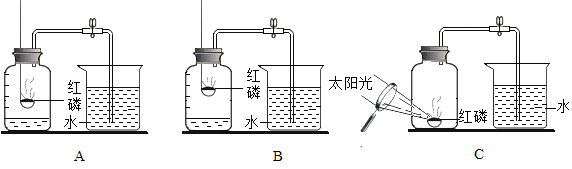
�����ʵ�飩��һС��ͬѧ��ͬ�������ͼ��A��B����װ�á�
��1������Ϊ�������ǣ����ţ�_____��
��2��������Ӧʽ��Ϊ_____��
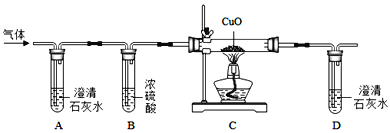
���Ľ�ʵ�飩�ڶ�С��ͬѧ�����Cʵ�飬�ŵ��ǣ�_____��
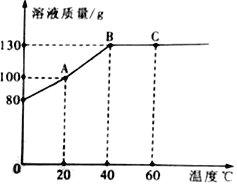
��1��ʵ����ֲⶨ���Ŀ����������������������l/5������������ļ���ԭ������ģ�_____��
��2����ʵ�����������֪������Լռ�����������1/5������ԼΪ4/5���ܹ��õ��ý�����Ҫ�������˵������й������ǣ�_____��
���𰸡�A P+O2![]() P2O5 ���� ���������㣻����װ�������Բ����ã�û�еȵ���ȴ�����¾ʹ�ֹˮ�е� ������ˮ������ˮ��Ӧ����ȼ�ա���֧��ȼ��
P2O5 ���� ���������㣻����װ�������Բ����ã�û�еȵ���ȴ�����¾ʹ�ֹˮ�е� ������ˮ������ˮ��Ӧ����ȼ�ա���֧��ȼ��
��������
[���ʵ��]��1��ʵ��A��B���������ں���λ�ã�����һ�����������ܶ��йأ������������ܶȴ��ڿ��������Ժ��������͵�λ�ø����ڷ�Ӧ�Ľ��У�Ҳ���������������ģ�����ʵ�����A��������
��2����ʵ���з�Ӧ�Ĺ����Ǻ���ȼ�գ��÷�Ӧ�IJ��������������ף��÷�Ӧ��ʽ���ǣ�P+O2![]() P2O5��
P2O5��
[�Ľ�ʵ��]��1������������ʵ��������������Ҫ����ȫ��Ϳ��ԣ�����ע�������С�����֮һ����������ҩƷ���ܽ�������ȫ�����йأ�Ҳ������װ��©������Ӧ��ɺ�û�еȵ�װ����ȴ�ʹ�ֹˮ�е��йأ�
��2�����ڵ��������ʣ��ڻش�ʱҪ�������ԱȻش�������Ӧ���ˣ�������ʣ���ˣ�˵�������Dz�ȼ��Ҳ��֧��ȼ�յģ�����ˮ�����е����ܹ���Ȼ������˵������������ˮ��Ҳ����ˮ������Ӧ��

����Ŀ���г��ϳ���һ��ϴ�Ӽ�����ǩ��ͼ������˲������·��Ϻ��ա���֭�յȶ���������ա�ij̽��С�����Ũ����Ȥ������ϴ�Ӽ���ȥ��ԭ������̽����

���������ϣ�
�ٹ���̼���ƣ�Na2CO4���ǰ�ɫ��������������������ȶ����¶ȸ���50��ʱ��ֽ⣬����ˮ�õ�����Һ�Լ��ԣ���ˮ��Ӧ�����̼���Ƽ�������������
��̼���ƾ���ȥ����������������������ϵ�������ա�
ʵ��һ�����ܽ�����Ʒ
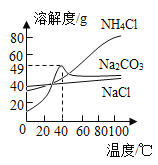
ȡ������ϴ�Ӽ���Ʒ����ƿ�У�������������ˮ�����ϴ����ܵ���Ƥ���������������ð���������γ���ɫ��Һa��������������ͨ��ʯ��ˮ��������ǣ�����Ƥ����____���������������________����˵�����Ϣ��е��������������������������
��������⣩����̼������ˮ��Ӧ����������������������ʲô��
��������裩
����1��H2O2
����2��NaOH
����3��H2O2��NaOH
ʵ�������֤����
��� | ʵ����� | ʵ������ | ��������� |
��1�� | ȡ������Һ a ���ձ��У�Ѹ�ټ����Թ��������ᱵ��Һ�����õ���Һ b�� | ������ɫ���� | �����Թ������ᱵ��Һ��Ŀ�ij�ȥ��Һ�е�̼���ơ���Ӧ����ʽΪ________�� |
��2�� | ȡ������Һ b ���Թ��У����������������̡� | ________ | ��Ӧ�Ļ�ѧ����ʽ��:____��֤������̼������ˮ��Ӧ��H2O2 ������ |
��3�� | ��ȡ������Һ b ���Թ��У��μ� 2 ~3 ���Ȼ�þ��Һ�� | ���������� | ________ |
��4�� | �����з�̪��������������ϡ��Һ�У����� 2 ~3 ����Һb�� | �����ݲ����� ________ | ����������ǿ�����������ֽ⣬�Ҿ���Ư���ԡ� |
��ʵ����ۣ�����________��ȷ��д������̼������ˮ��Ӧ�Ļ�ѧ����ʽ________��
����˼���ۣ���ϴ�Ӽ�Ӧ________���档
����Ŀ������ʵ�鷽���ܴﵽʵ��Ŀ�ĵ��ǣ� ��
ѡ�� | ʵ��Ŀ�� | ʵ�鷽�� |
A | ��ȥ | ��������п�� |
B | ����һƿ�����Ƿ�Ϊ | ��ȼ�ŵ�ľ������ƿ�� |
C | ��������ȼ�յIJ������Ƿ���ˮ | �ڻ����Ϸ���һֻ���������ձ� |
D | ����ͭ�ۺ����� | ��ˮ������ |
A. A B. B C. C D. D