题目内容
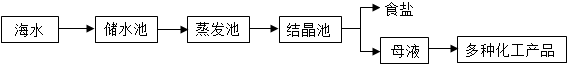
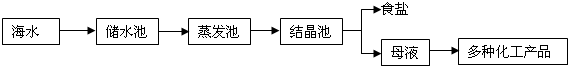
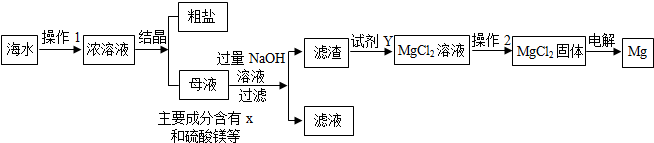
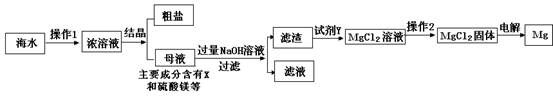
海水又苦又咸,是因为其中含有大量的Na+、Cl-和一些Mg2+、Ca2+、SO42- 等.目前世界上60%的镁是从海水中提取的,其主要步骤如下: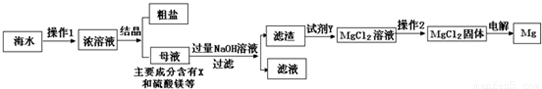
请根据流程图回答:
(1)操作2的名称是______,试剂Y显酸性,它是______;
(2)母液中的X是______,请写出母液中含有的微粒______;
(3)氯化镁固体的电解属分解反应,写出该反应的化学方程式:______ Mg+Cl2↑
【答案】分析:(1)由于氯化镁溶解度受温度的影响决定了通过什么方法使溶质从它的饱和溶液中结晶析出;
(2)根据母液的成分分析含有的离子进行解答;
(3)根据电解氯化镁生成金属镁和氯气进行解答.
解答:解:(1)由于氯化镁溶解度受温度的影响变化不大,所以操作2的名称是蒸发结晶;因为生成氯化镁且Y显酸性,它是盐酸;
(2)海水在蒸发溶剂的条件下由不饱和溶液变成过饱和溶液,食盐因此结晶析出;②大部分食盐在结晶析出的同时,也会有很少的其他的晶体从溶液中结晶析出,但溶液中仍旧会有少量的氯化钠,母液中可能含有的微粒是:Na+、Cl-、Mg2+、Ca2+、SO42-、H2O;
(3)电解氯化镁生成金属镁和氯气,该反应的化学方程式:MgCl2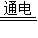 Mg+Cl2↑.
Mg+Cl2↑.
故答案为:(1)蒸发结晶;盐酸;
(2)NaCl;Na+、Cl-、Mg2+、Ca2+、SO42-、H2O;
(3)MgCl2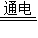 Mg+Cl2↑.
Mg+Cl2↑.
点评:化学来源于生产、生活,又服务于生产、生活,工业从海水中提取镁是初中化学的重要应用之一,是考查重点,常涉及有关化学方程式的书写.
(2)根据母液的成分分析含有的离子进行解答;
(3)根据电解氯化镁生成金属镁和氯气进行解答.
解答:解:(1)由于氯化镁溶解度受温度的影响变化不大,所以操作2的名称是蒸发结晶;因为生成氯化镁且Y显酸性,它是盐酸;
(2)海水在蒸发溶剂的条件下由不饱和溶液变成过饱和溶液,食盐因此结晶析出;②大部分食盐在结晶析出的同时,也会有很少的其他的晶体从溶液中结晶析出,但溶液中仍旧会有少量的氯化钠,母液中可能含有的微粒是:Na+、Cl-、Mg2+、Ca2+、SO42-、H2O;
(3)电解氯化镁生成金属镁和氯气,该反应的化学方程式:MgCl2
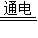 Mg+Cl2↑.
Mg+Cl2↑.故答案为:(1)蒸发结晶;盐酸;
(2)NaCl;Na+、Cl-、Mg2+、Ca2+、SO42-、H2O;
(3)MgCl2
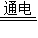 Mg+Cl2↑.
Mg+Cl2↑.点评:化学来源于生产、生活,又服务于生产、生活,工业从海水中提取镁是初中化学的重要应用之一,是考查重点,常涉及有关化学方程式的书写.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目