题目内容
(2010?萝岗区一模)(1)将硝酸铵晶体溶于水,溶液的温度(填升高或降低);(2)人们以海水为原料提取食盐的工艺流程如下:
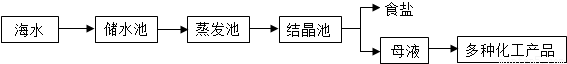
①海水又苦又咸,是因为其中含有大量的Na+、Ca2+、Cl-、Mg2+、SO42-等.以海水提取食盐的原理是:.
②根据上述工艺流程图可知,母液中含有的离子是.
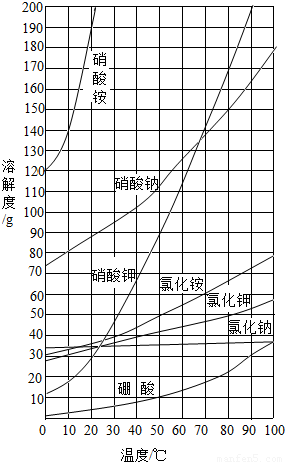
(3)根据如图所提供的溶解度曲线,计算:10℃时饱和硝酸铵溶液中溶质的质量分数是(精确到0.1%);
【答案】分析:首先要明白物质溶于水时会伴随着能量的变化,如:氢氧化钠固体、生石灰、浓硫酸溶于水时会放热,而硝酸铵溶于水时会吸热,使温度降低;由于溶解度受温度的影响决定了通过什么方法使溶质从它的饱和溶液中结晶析出,如:氯化钠的溶解度受温度的影响很小,因此主要采取蒸发溶剂的方法使氯化钠从饱和溶液中结晶析出,而硝酸钾的溶解度随温度的升高而增大,且受温度的影响很大,因此主要采取降温结晶的方法使硝酸钾从饱和溶液中结晶析出;弄清固体溶解度和同温度下的饱和溶液中溶质的质量分数间的关系,关键是对固体溶解度概念的理解:在一定温度下,某固体物质在100克溶剂中达到饱和状态时所溶解的质量.
解答:解:(1)由于硝酸铵固体溶于水时会吸热,因此会导致温度降低,故答案为:降低
(2)①由于氯化钠的溶解度受温度的影响很小,因此食盐从海水中结晶析出,主要利用了蒸发溶剂的方法,故答案为:海水在蒸发溶剂的条件下由不饱和溶液变成过饱和溶液,食盐因此结晶析出
②大部分食盐在结晶析出的同时,也会有很少的其他的晶体从溶液中结晶析出,但溶液中仍旧会有少量的氯化钠,故答案为:Na+、Ca2+、Cl-、Mg2+、SO42-
(3)由于在10℃时,硝酸铵的溶解度是140克,即100克水中最多溶解140克硝酸铵,则在10℃时,硝酸铵的饱和溶液中溶质的质量分数是 ×100%=58.3%,故答案为:58.3%.
×100%=58.3%,故答案为:58.3%.
点评:该题难度不是很大,主要考查了固体溶解度概念的理解,并根据固体溶解度的概念来求其饱和溶液中溶质的质量分数,及海水晒盐的过程和原理.
解答:解:(1)由于硝酸铵固体溶于水时会吸热,因此会导致温度降低,故答案为:降低
(2)①由于氯化钠的溶解度受温度的影响很小,因此食盐从海水中结晶析出,主要利用了蒸发溶剂的方法,故答案为:海水在蒸发溶剂的条件下由不饱和溶液变成过饱和溶液,食盐因此结晶析出
②大部分食盐在结晶析出的同时,也会有很少的其他的晶体从溶液中结晶析出,但溶液中仍旧会有少量的氯化钠,故答案为:Na+、Ca2+、Cl-、Mg2+、SO42-
(3)由于在10℃时,硝酸铵的溶解度是140克,即100克水中最多溶解140克硝酸铵,则在10℃时,硝酸铵的饱和溶液中溶质的质量分数是
 ×100%=58.3%,故答案为:58.3%.
×100%=58.3%,故答案为:58.3%.点评:该题难度不是很大,主要考查了固体溶解度概念的理解,并根据固体溶解度的概念来求其饱和溶液中溶质的质量分数,及海水晒盐的过程和原理.

练习册系列答案
相关题目