题目内容
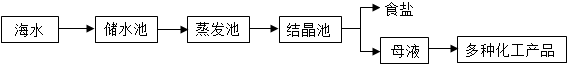
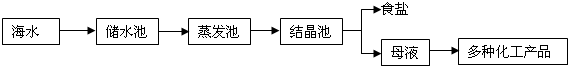
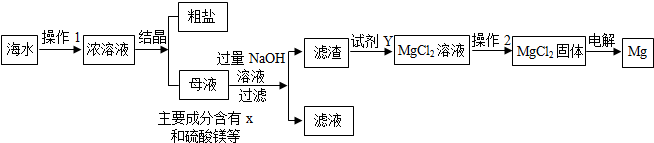
(7分)海水又苦又咸,是因为其中含有大量的Na+、Cl-和一些Mg2+、Ca2+、SO42- 等。目前世界上60%的镁是从海水中提取的,其主要步骤如下:
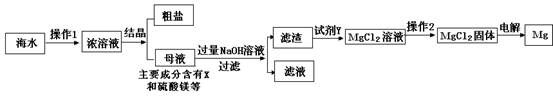
请根据流程图回答:
1.操作2的名称是 ,试剂Y显酸性,它是 ;
2.母液中的X是 ,请写出母液中含有的微粒 ;
3.氯化镁固体的电解属分解反应,写出该反应的化学方程式: 。
(共7分)
1. 蒸发结晶 (1分), 盐酸 (1分);
2.NaCl(1分), Na+ 、Cl-、Mg2+、Ca2+、SO42- 、H2O (2分)
3. MgCl2 Mg+ Cl2↑(2分)
Mg+ Cl2↑(2分)
解析:
1.将溶液蒸干的操作是蒸发结晶。因为生成的是氯化镁,Y又显酸性,所以Y是盐酸。
2.海水中含有大量的是氯化钠,所以X的主要成分为氯化钠,海水中含有的粒子有Na+ 、Cl-、Mg2+、Ca2+、SO42- 、H2O。

练习册系列答案
相关题目