题目内容
【题目】鸡蛋壳的主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g一定质量分数的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好完全反应。试计算(计算结果保留1位小数):
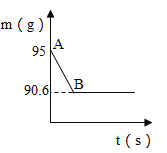
(1)产生CO2的质量为g;
(2)该鸡蛋壳中CaCO3的质量分数;
(3)反应后滤去不溶物所得溶液中溶质的质量分数。
【答案】(1)4.4g
(2)66.7%
(3)13.0%
【解析】
(1)碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,由于有二氧化碳生成,随着反应的进行,烧杯中剩余物的质量逐渐减小,生成二氧化碳的质量为:95g-90.6g=4.4g;
(2)解:设鸡蛋壳中碳酸钙的质量为x,反应生成氯化钙的质量为y
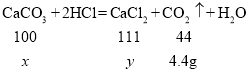
![]() x=10g
x=10g
![]() y=11.1g
y=11.1g
鸡蛋壳中碳酸钙的质量分数为:![]() ;
;
答:鸡蛋壳中CaCO3的质量分数为66.7%;
(3)反应后滤去不溶物所得溶液中溶质的质量分数为:![]()
答:反应后滤去不溶物所得溶液中溶质的质量分数为13.0%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目