题目内容
【题目】某纯净物6g在氧气中完全燃烧,生成17.6g二氧化碳和10.8g水,下列说法不正确的是( )
A. 该反应中O2和CO2的质量比为14:11
B. 该纯净物中O2和H2O的分子数之比是7:6
C. 该纯净物中C、H原子的个数比为1:4
D. 该纯净物中含有C、H元素,不含O元素
【答案】C
【解析】
A、该反应中氧气和二氧化碳的质量比为22.4g:17.6g=14:11,故选项说法正确。
B、该反应中氧气和水的分子个数比为![]() :
:![]() =7:6,故选项说法正确。
=7:6,故选项说法正确。
C、该化合物中碳元素、氢元素质量比为:(17.6g×![]() ):(10.8g×
):(10.8g×![]() )=4:1,C、H原子的个数比为
)=4:1,C、H原子的个数比为![]() :
:![]() =1:3,该选项说法错误。
=1:3,该选项说法错误。
D、反应的氧气质量为:17.6g+10.8g﹣6g=22.4g,二氧化碳中的碳元素和水中的氢元素来自于该物质,该物质中氧元素质量为:17.6g×![]() +10.8g×
+10.8g×![]() ﹣22.4g=0,则该化合物中一定含有C、H元素,一定不含O元素,该选项说法正确。
﹣22.4g=0,则该化合物中一定含有C、H元素,一定不含O元素,该选项说法正确。
故选:C。

练习册系列答案
相关题目
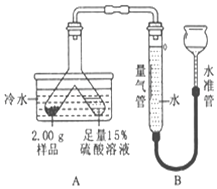
【题目】泡腾片配料表如下:
成分 | 柠檬酸 | 碳酸氢钠 | 维生素C | 乳糖 | 色素香精 |
每片含量(4 g/片) | 未知 | 未知 | 0.2 g | 未知 | 极少量 |
泡腾片放入温开水中,浮于水面上,产生大量气泡,所得溶液喝起来酸甜可口。已知:柠檬酸的化学式为C6H8O7,相对分子质量为192;泡腾片溶于水时,碳酸氢钠刚好与柠檬酸完全反应,生成Na3C6H5O7。
(1)泡腾片在水中产生气体的化学式为_____。泡腾片中柠檬酸与碳酸氢钠的质量比为_____。
(2)称取5.00 g泡腾片放入200.00 g温开水中,待泡腾片完全溶解,不再产生气体后,测得溶液质量为203.68 g.通过计算确定泡腾片中柠檬酸的质量分数_____。