题目内容
【题目】空气是人类最宝贵的自然资源。空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应.图1是以空气和其他必要的原料合成氮肥(NH4HCO3)的流程.请按要求回答下列问题:
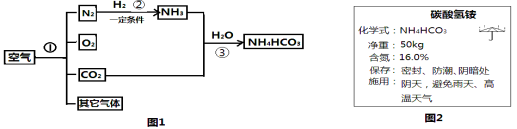
(1)步骤①中可利用氮气和氧气的 不同分离出氮气和氧气。
(2)写出步骤②中发生反应的化学式表达式 。
(3)图2是化肥碳酸氢铵包装袋上的部分说明:碳酸氢铵具有的性质是 (填字母).
A.易溶于水 B.有挥发性 C.受热易分解
(4)这种化肥含氮量是否达到16%,化肥中碳酸氢铵的含量是多少?带着这些问题,兴趣小组的同学取了一些化肥样品,进入实验室。
【查找资料】①碱石灰能够吸收水和CO2,但是不吸收NH3。
②浓硫酸能吸收NH3但是不吸收CO2。
③氨气溶于水形成氨水
【性质探究】该同学设计了如下的实验装置:

①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是 。
②取适量碳酸氢铵加入试管,连接A、C、E装置,加热,E中的现象是 。
③连接A、B装置,继续加热,观察到试管口的现象是 ,B中的现象是 。
④碳酸氢铵在受热时发生反应的化学式表达式是 。
【含量分析】将装置A、C、D依次连接,加入20g化肥样品,加热至A中固体完全消失。
她称量装置D的质量如表:
实验前D装置的质量 | 149g |
实验后D装置的质量 | 152.4g |
⑤由此分析得知:反应中产生氨气的质量为 g。
⑥通过反应的表达式可以知道:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥含氮元素质量分数为 。
⑦请计算此化肥中碳酸氢铵的纯度 。
⑧ 千克的硝酸铵(NH4NO3)和这袋化肥的含氮元素质量相等.
【答案】(1)沸点
(2)H2 +N2→NH3
(3)AC
(4)①查装置气密性 ②无色酚酞试液变红 ③有水滴 变浑浊
④NH4HCO3![]() NH3+H2O+CO2
NH3+H2O+CO2
⑤3.4 ⑥14% ⑦79% ⑧20
【解析】
试题分析:(1)空气是由氮气、氧气、二氧化碳等气体组成的,通过分离空气的方法可得到空气中的各种成分。步骤①就是分离液态空气,即可利用氮气和氧气的沸点不同将氮气和氧气分离出来;
(2)根据反应流程可知步骤②是氮气和氢气反应生成氨气:H2 +N2→NH3;
(3)根据化肥碳酸氢铵的保存和施用方法可知碳酸氢铵易溶于水,且受热易分解,故选AC;
(4)①用A装置给碳酸氢铵加热,装药品前,要检查装置的气密性,以免漏气;
②碳酸氢铵与水反应生成氨水,氨水呈碱性,能使无色酚酞试液变红,故现象是E中无色酚酞试液变红;
③碳酸氢铵会分解生成水和二氧化碳,故试管口会有水滴,除去的石灰水会变浑浊;
④碳酸氢铵会分解生成氨气、水和二氧化碳:NH4HCO3![]() NH3+H2O+CO2;
NH3+H2O+CO2;
⑤D装置中盛放的是浓硫酸,根据资料可知浓硫酸只能吸收氨气,不能吸收二氧化碳,故D装置中增加的质量即为生成的氨气的质量,即氨气的质量=152.4g-149g=3.4g ;
⑥根据质量守恒定律化学反应前后元素的质量不变,即氨气中氮元素的质量等于碳酸氢铵中氮元素的质量。
3.4g氨气中氮元素的质量=3.4g×14/17 ×100% =2.8g ;即碳酸氢铵中氮元素的质量为2.8g,故此化肥中氮元素的质量分数=2.8g/20g ×100% =14% ;
⑦碳酸氢铵的相对分子质量=14+5+12+16×3=79
碳酸氢铵中氮元素的质量分数=14/79 ×100% =17.7%
此化肥中碳酸氢铵的纯度=14%÷17.7% ×100% =79% ;
⑧根据计算可知该袋化肥中氮元素的质量=50kg×14% = 7kg
硝酸铵中氮元素的质量分数=28/80 ×100% =35% ,
那么硝酸铵的质量=7kg ÷35% =20kg

【题目】新的一年,同学们的学习方式有了很大变化。下面是《气体制取与收集》学习的课堂片段:
【自主学习】仿照氧气制取的学习和气体制取的一般思路,阅读课本,老师提供了几组药品,让同学们交流并选出适宜实验室制取二氧化碳的一组。
【合作交流】围绕以上问题,各小组展开了激烈的交流,下面是老师从第二小组同学交流中听到的各位学生的发言:
1号:碳酸盐用块状石灰石(主要成分碳酸钙),为什么不用纯碱(碳酸钠)呢?
3号:碳酸钠是粉未状的,反应的速度太快,不易控制,
2号:同意3号同学的说法,那我们把碳酸钠压制成块状可以吗?
各位都在思考,问题未能解决。
【展示释疑】通过各个小组的展示,大家明白了实验室制取二氧化碳应该选择石灰石和稀盐酸。
实际实验中,所用的原料或产物一般都含有杂质,在计算用料和产量时,应考虑到杂质问题。
请你帮助二组学生解决2号学生提出的问题,实验室把碳酸钠压制成块状_______(选填“可以”或“不可以”)代替石灰石制取二氧化碳。
【能力提升】某小组想测定所用石灰石样品中碳酸钙的质量分数,取用了2g的石灰石样品,把20g稀盐酸(氯化氢的水溶液)分4次加入样品中,(样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶解于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入5g | 1.5g |
第二次加入5g | 1.0g |
第三次加入5g | 0.5g |
第四次加入5g | 0.3g |
(1)从以上数据可知,这四次实验中,第______次石灰石样品中碳酸钙已完全反应。
(2)求石灰石中碳酸钙的质量分数?
(3)求检测过程中所产生二氧化碳的质量?
