��Ŀ����
����Ŀ����ѧ��ȤС��������ʦ��ָ���£������ϸ���֭Һ�����кͷ�Ӧʵ�顣
����ʾʵ�顿ȡ�������õ�NaOH��Һ�������뼸���ϸ���֭Һ(��Һ���ϱ��)��Ȼ�����ɫNaOH��Һ����μ���ϡ���ᣬ������Һ��ð���ݣ�����Һ�����������γ��ֻ�ɫ����ɫ����ɫ����ɫ���ۺ졢���ɫ�ȣ������ʺ硢�dz�������
̽����.Ϊʲô��Ӧ��������Һ����ֶ�ʵ���ɫ
�����в��롿
Сͮ���룺�����Ƿ�Ӧ�����У���Һ�и���λ�ϸ���֭Һ��Ũ�Ȳ�ͬ��
С�ܲ��룺�����Ƿ�Ӧ�����У���Һ�и���λ������(pH)��ͬ��
��ʵ����֤��
��1����С�ձ��м��������ϸ���֭Һ��Ȼ������������ˮ����Һʼ������ɫ��
��2������һ��С�ձ��м������������Ƶ�NaOH��Һ��Ȼ����μ���ϡ�����ʱ�۲���Һ��ɫ�ı仯��ͬʱ�ô����������Ӧ��������ҺpH�ı仯��
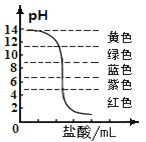
��3��������ҺpH����ɫ�ı仯ͼ(����ͼ)����ͼ��֪�� �IJ�������ȷ�ġ�
����չ���졿�����ͼ˼����
��1�������ǡ����ȫ�к�ʱ����Һ�� ɫ�����кͷ�Ӧ�Ļ�ѧ����ʽ�ǣ� ��
��2������Һ�ʺ�ɫʱ����Ӧ��Һ�е�����Ϊ ��
̽����.���õ�NaOH��Һ�����ʳɷ�
���������ϡ�BaCl2��Һ�����ԣ�BaCl2+Na2CO3=BaCO3��+2NaCl��
��ʵ����֤��
��1��С����Ϊ����Ϊ����õ�NaOH��Һ�еμ�ϡ����ʱ���������ݣ����Ը���Һ�ѱ��ʡ����û�ѧ����ʽ��ʾNaOH��Һ���ʵ�ԭ�� ��
��2��С��ȡ�������õ�NaOH��Һ���������� ��������ɫ�����������ϲ���Һ�е��뼸���ϸ���֭Һ����Һ�Ի�ɫ����ˣ���ƿ���õ�NaOH��Һ�����ʳɷ��� ��
��3��С��ȡ�������õ�NaOH��Һ����μ�������ϡ���ᣬ (����������Ժ�)�д��������ݲ�����С��ݴ�Ҳ�ó���С����ͬ�Ľ��ۡ�
�����۷�˼��
��1����ȡ�ϸ�����֭Һ�����þƾ���Һ���ݣ�ԭ���� (��д���)��
���ϸ���ɫ�������ھƾ� ���Ƶõ��ϸ���֭Һ���ױ���
��2����Ϊ���ָʾ�����ϸ���֭Һ��ʯ����Һ��ȣ��ŵ����ԣ������ܲ����Һ������ԣ�������ʾ��Һ ��
���𰸡�̽����.��ʵ����֤����3��С������չ���졿��1���� HCl+NaOH=NaCl+H2O��2��NaCl��HCl ̽����.��ʵ����֤����1��CO2+2NaOH==Na2CO3+H2O��2��BaCl2��Һ��CaCl2��Һ NaOH ��Na2CO3��3���Ժ� �����۷�˼����1���٢ڣ�2�������ǿ�������Ȼ�һ����Χ�ڵ�pH
��������
�����������������Ϣ֪��̽��������3��������ҺpH����ɫ�ı仯ͼ(����ͼ)����ͼ��֪С�ܵIJ�������ȷ�ġ�����չ���졿�����ͼ˼������1�������ǡ����ȫ�к�ʱ����Һ����ɫ�����кͷ�Ӧ�Ļ�ѧ����ʽ�ǣ�HCl + NaOH == NaCl + H2O����2������Һ�ʺ�ɫʱ����Ӧ��Һ�е�����ΪNaCl��HCl��
̽����.���õ�NaOH��Һ�����ʳɷ���1��С����Ϊ����Ϊ����õ�NaOH��Һ�еμ�ϡ����ʱ���������ݣ����Ը���Һ�ѱ��ʡ����û�ѧ����ʽ��ʾNaOH��Һ���ʵ�ԭ��CO2 + 2 NaOH == Na2CO3 + H2O��
��2��С��ȡ�������õ�NaOH��Һ����������BaCl2��Һ��CaCl2��Һ��������ɫ�����������ϲ���Һ�е��뼸���ϸ���֭Һ����Һ�Ի�ɫ����ˣ���ƿ���õ�NaOH��Һ�����ʳɷ���NaOH ��Na2CO3��
��3��С��ȡ�������õ�NaOH��Һ����μ�������ϡ���ᣬ�Ժ��д��������ݲ�����С��ݴ�Ҳ�ó���С����ͬ�Ľ��ۡ������۷�˼����1����ȡ�ϸ�����֭Һ�����þƾ���Һ���ݣ�ԭ���Ǣ��ϸ���ɫ�������ھƾ����Ƶõ��ϸ���֭Һ���ױ��ʡ���2����Ϊ���ָʾ�����ϸ���֭Һ��ʯ����Һ��ȣ��ŵ����ԣ������ܲ����Һ������ԣ�������ʾ��Һ�����ǿ�������Ȼ�һ����Χ�ڵ�pH��
����ÿ��黯ѧʵ��̽���Ļ���˼·�ͷ�����

 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�