题目内容
【题目】水是我们很熟悉的物质,学习化学以后,我们对水有了一些新的认识。
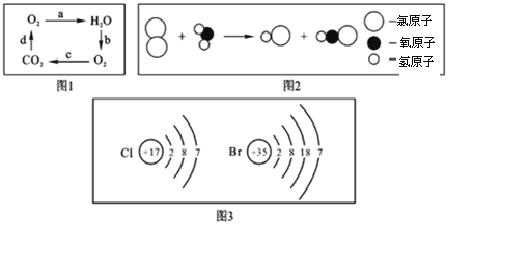
(1)知道了水的微观结构。构成水的粒子可表示为 (填序号)。

(2)通过电解水的实验了解了水的组成。在水中氢元素与氧元素的质量比 。
(3)生活中常用明矾来净化自来水,明矾的作用是 ,明矾经搅拌静置一段时间后进行过滤操作,该操作中要用到的玻璃仪器有烧杯、 和玻璃棒,其中玻璃棒的作用是 。
【答案】(1)A(2)1∶8(3)吸附,漏斗,引流。
【解析】
试题分析∶由题中信息知,(1)构成水的粒子可表示为A。(2)在水中氢元素与氧元素的质量比1∶8.(3)生活中常用明矾来净化自来水,明矾的作用是吸附,明矾经搅拌静置一段时间后进行过滤操作,该操作中要用到的玻璃仪器有烧杯、漏斗和玻璃棒,其中玻璃棒的作用是引流。
考点∶考查与水相关的知识。

【题目】结合下列实验装置图回答问题:
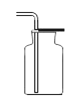
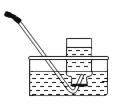
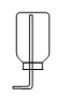

A B C D E F
(1)实验室选用A装置来制取氧气,发生反应方程式为 。若用A和F装置制取氧气,当实验结束时,有同学先熄灭了酒精灯,忘记将导管从水中取出,在水未进入导管之前,可采取的补救措施是 。
(2)实验室选用B装置来制取氧气,则发生反应方程式为 ,若装置B反应很剧烈,据此提出实验安全注意事项是 。(请填写序号)
①控制滴液速度;②用小体积的锥形瓶;③加热反应物;④降低反应物浓度
(3)实验室制备CO2的化学方程式为: 。采用装置C相对于装置B在操作方面的优势为: 。装置C气密性检查的方法是: 。
(4)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
比较项目 | 排水法 | 向上排空气法 |
收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率。 | CO2密度比空气大,且① |
收集过程分析 | 集满现象② | “验满”分析:因气体无色,故集满与否较难确定。即便用燃着的木条移近容器口火焰熄灭,也难以证明空气完全排尽。 |

(5)实验室常用加热硫酸铵和熟石灰两种固体混合物来制取氨气。氨气极易溶于水,且密度比空气小,获取氨气的组合装置应选用 (从装置A~F中选择)。若使用右下图所示装置收集氨气,则气体应从 (填“a”或“b”)通入。
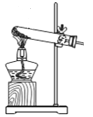
【题目】小明同学在家里的药箱中发现一瓶用来清洗伤口用的消毒液——“双氧水”,他联想到在化学课上曾用过氧化氢溶液制取过氧气,他高兴的将家中的“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验。

【第一组实验】小明欲证明该双氧水是否失效。
(1)实验过程
①在试管中加入5 mL “双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
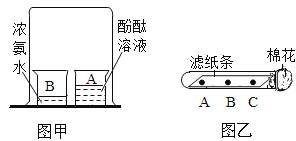
③如图装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是 。
(2)实验结论: 。
【第二组实验】小明欲探究Fe2O3能否作为H2O2分解的催化剂,并与MnO2的催化效果进行比较。小明、小李、小张三位同学同时进行H2O2的分解与气体的收集实验。实验时间均以30秒生成气体为准(H2O2均未全部分解)(见图甲),其他可能影响实验的因素均忽略。相关数据如下:


同学序号 | 质量分数相同的H2O2溶液 | 溶液中加入的物质 | 收集到的气体体积 |
小明 | 100 ml | 未加其他物质 | a ml |
小李 | 100 ml | Fe2O3 0.5 g | b ml |
小张 | 100 ml | MnO2 0.5 g | c ml |
(1)若50mL量气管中液面的位置如图乙所示,A与B刻度间相差1 mL,刻度A为20,则此时气体的体积为 mL。
(2)欲探究Fe2O3在实验中是否起催化作用,首先应比较 和 (选择a、b、c填空)的大小,还需补充做如下实验(无需写出具体操作步骤):
① ;
② 。
实验结论:Fe2O3能加快H2O2的分解,起催化作用。
(3)通过比较Fe2O3 和MnO2 在反应中的反应速率,发现Fe2O3 的催化效果没有二氧化锰好。