题目内容
某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
(1)用pH试纸测定溶液的pH时,正确的操作是:
。
(2)简述强调“测得的pH小于7”的理由: 。
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了。该小组对这种意外现象的原因作了如下猜想:①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液。实验中“加热”和“滴入植物油”目的是 。实验结果表明酚酞溶液红色消失与空气中的氧气无关。
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:
结论1:说明Na2CO3溶液呈 性;
结论2:说明酚酞溶液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度很大时,就会出现上述意外现象。请设计实验证明该方案中取用的NaOH溶液浓度过大:①实验方法
,②观察到的现象 。
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65﹪ | 2.00﹪ | 3.5 |
| 2 | 3.65﹪ | 4.00﹪ | x |
| 3 | 7.30﹪ | 8.00﹪ | 14 |
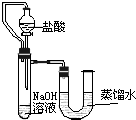
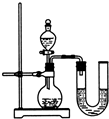
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。

⑶关于实验中的细节和意外情况:
①实验中,稀盐酸必须用胶头滴管逐滴滴加,这样做的目的是 。
②实验过程中,要用玻璃棒不断搅拌,这样做的目的是 。
③在实验过程中意外发现有气泡出现,你认为原因是 。
④发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:① 可能是NaOH;你认为:② 可能是__________; ③ 可能是_________________________。
⑷为了进一步研究实验中出现的问题,取了13.3g氢氧化钠固体样品加适量的水配成溶液,
向其中加入200g10%的稀盐酸,使其充分反应,生成二氧化碳2.2g。求:
⑴样品中氢氧化钠的质量;
⑵和氢氧化钠反应的盐酸的质量;
⑶在右图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸的质量的关系图。
(已知Na2CO3 +2HCl ="==" 2NaCl + H2O+CO2↑)

方案一: (1)将PH试纸放在表面皿上,用玻璃棒蘸取少量待测液滴在试纸上,将试纸颜色与比色卡对照读出pH。(2分)
(2) 排除因稀释而使溶液pH减小的因素 。
方案二:(1) 除氧和隔氧 。(2) 碱 ;
(3) 取上述溶液加水稀释后,再滴加无色酚酞 ,② 溶液呈红色不消失 。
方案三: (1) 7 。(2)U型管中液面左低右高
⑶ ① 防止稀盐酸过量 ② 使反应充分
③ 氢氧化钠溶液中含有碳酸钠
④Na2CO3 NaOH与Na2CO3的混合物
⑷①8g;② 73g;
③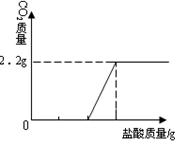
解析试题分析:方案一:(1)用pH试纸测定溶液的pH时,正确的操作是:将PH试纸放在表面皿上,用玻璃棒蘸取少量待测液滴在试纸上,将试纸颜色与比色卡对照读出pH。
(2)向氢氧化钠溶液中加入稀盐酸,发生了中和反应,化学方程式为:NaOH+HCl=NaCl+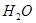 ,随着反应的进行,氢氧化钠逐渐被消耗掉,盐酸逐渐过量,生成的氯化钠和水都呈中性,故最终溶液呈酸性,PH小于7。
,随着反应的进行,氢氧化钠逐渐被消耗掉,盐酸逐渐过量,生成的氯化钠和水都呈中性,故最终溶液呈酸性,PH小于7。
方案二:(1)实验中“加热”和“滴入植物油”目的是除去溶液中的氧气和隔觉空气中的氧气。
(2)取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:结论1:说明Na2CO3溶液呈碱性;
结论2:说明酚酞溶液红色消失与空气中的二氧化碳无关。
(3)当氢氧化钠溶液浓度很大时,就会出现上述意外现象。为了证明该方案中取用的NaOH溶液浓度过大:①实验方法取上述溶液加水稀释后,再滴加无色酚酞 ,②观察到的现象是溶液呈红色不消失,说明的确是因为氢氧化钠溶液浓度过大所致。
方案三:(1)由表中数据规律可知,当盐酸或者氢氧化钠浓度增大一倍时,溶液温度升高3. 5℃,表中x=7;
(2)①实验中,稀盐酸必须用胶头滴管逐滴滴加,这样做的目的是防止稀盐酸过量。
②实验过程中,要用玻璃棒不断搅拌,这样做的目的是使反应充分进行。
③在实验过程中意外发现有气泡出现,原因是氢氧化钠溶液中含有碳酸钠。
④发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。则该粉末可能是NaOH、Na2CO3、NaOH与Na2CO3的混合物。
⑷解:①设固体样品中碳酸钠的质量为x,跟碳酸钠反应的盐酸的质量为y
Na2CO3 +2HCl ="==" 2NaCl + H2O+CO2↑
106 73 44
x y×10% 2.2g
106:x=73:(y×10%)=44:2.2g
x=5.3g y=36.5g
NaOH的质量为:13.3g-5.3g=8g
答:NaOH的质量为8g。
②设和氢氧化钠反应的盐酸的质量为z
NaOH+ HCl ="==" NaCl + H2O
40 36.5
8g z ×10%
40:36.5=8g:(z×10%)
z=73g
答:和氢氧化钠反应的盐酸的质量为73g。
③二氧化碳与盐酸的质量的关系图为: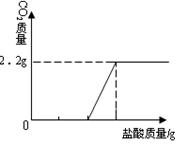
考点:实验设计与探究;溶液的PH;酸碱指示剂;根据化学方程式计算;化学反应中的质量关系图。
点评:本题考查的知识点很多,涉及的内容很多,篇幅较长,做起来难度很大,同学们要耐心读完题目,理解题意,这对解答此类题目很重要。根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。

I、实验方案
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.
(1)用pH试纸测定NaOH溶液pH时,正确的操作是:
(2)简述强调“测得的pH小于7”的理由:
方案二:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生.如果
NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应.
该组同学将不同浓度的盐酸和NaOH溶液各10克混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表).
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验.则该同学根据
II、实验中的意外情况
在实验过程中,他们发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:①可能是NaOH;②可能是Na2CO3; ③可能是NaOH和Na2CO3.
(1)小明同学取白色粉末少许,溶于水后,先向溶液中加入足量的
(2)为了进一步研究,三位同学取了10.0g上述样品,利用电子天平共同做了下图所示的实验.
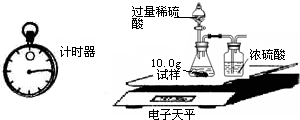
实验数据记录如下:
| 称 量 项 目 | 称 量 时 间 | 质量(g) |
| 试样 | 10.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 249.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 249.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 249.00 |
(3)有同学提出按上述实验所测得试样中Na2CO3质量分数会偏小,该同学的理由是(实验操作均正确):


 物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.