题目内容
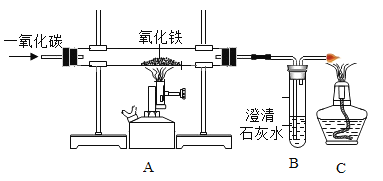
【题目】实验室模拟炼铁
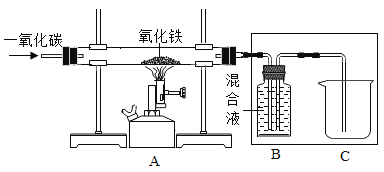
已知B装置中的液体为过量的氢氧化钠与氢氧化钙混合溶液,氢氧化钠吸收二氧化碳能力比氢氧化钙强。请回答下列问题:
(1)实验过程中A处玻璃管中现象:_____,写出B处反应的化学方程式:_____。
(2)实验装置按图连接,请将以下四步按正确操作步骤排序:_____(填序号)。
a.点燃A处酒精喷灯
b.通入CO
c.停止通入CO
d.熄灭酒精喷灯
(3)实验装置图中虚线框内装置起到的作用有_____(填序号)。
A.收集一氧化碳
B.吸收二氧化碳
C.检验二氧化碳
(4)已知此反应过程中温度不同,可能生成铁的不同的氧化物。原固体Fe2O3质量为48. 0g,现用热分析仪记录CO与Fe2O3进行反应时有关数据,得到固体质量与反应温度的关系曲线如图所示。
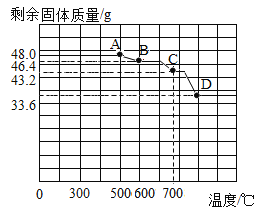
①根据图象分析,写出D点时固体成分的化学式_____。
②若B点生成物为一成分固定的化合物,请确定其化学式是_____。
【答案】玻璃管里的粉末由红棕色逐渐变黑 CO2+2NaOH=Na2CO3+H2O,CO2+Ca(OH)2=CaCO3↓+H2O badc ABC Fe Fe3O4
【解析】
(1)实验过程中A处发生的反应是红棕色的氧化铁和一氧化碳反应生成黑色的铁,因此玻璃管中的现象是:玻璃管里的粉末由红棕色逐渐变黑。因为B装置中的液体为过量的氢氧化钠与氢氧化钙混合溶液,因此装置中B处发生的反应有两个,化学方程式为:CO2+2NaOH=Na2CO3+H2O,CO2+Ca(OH)2=CaCO3↓+H2O。
(2)因为一氧化碳具有可燃性,如果一氧化碳和氧气混合,加热时可能发生爆炸,而实验装置的玻璃管中有空气,所以实验开始时必须先通一氧化碳,排尽装置内的空气后再加热;因为实验结束时,如果先停止通一氧化碳,空气就会进入玻璃管,灼热的铁就会被空气中的氧气氧化,所以结束时必须先停止加热,待装置冷却至室温再停止通一氧化碳。因此实验中正确操作步骤排序为:badc。
(3)因为部分一氧化碳和氧化铁不能完全反应,所以尾气中含有未参加反应的一氧化碳,如果直接排放会污染空气,实验装置图中虚线框内装置B中液体为过量的氢氧化钠与氢氧化钙混合溶液,且氢氧化钠吸收二氧化碳能力比氢氧化钙强,氢氧化钠溶液能吸收反应生成的二氧化碳,氢氧化钙溶液能检验反应中有二氧化碳生成,且该装置中两根导管都伸至集气瓶的底部,可以收集没有参加反应的一氧化碳气体,因此实验装置图中虚线框内装置起到的作用有:ABC。
(4)①原固体Fe2O3质量为48. 0g,计算可得其中铁元素的质量为![]() ,根据图象,D点时固体质量为33.6g,因此D点固体成分为铁单质,其化学式是:Fe。
,根据图象,D点时固体质量为33.6g,因此D点固体成分为铁单质,其化学式是:Fe。
②因为质量为48. 0g的Fe2O3中铁元素质量为33.6g,而剩余固体中铁元素质量不变,所以B点生成物中铁元素的质量也为33.6g。根据铁元素的质量,B点生成物中氧元素的质量为:46.4g-33.6g=12.8g,根据题意若B点生成物为一成分固定的化合物,设B点生成物的化学式为FexOy,![]() ,解得
,解得![]() ,则得出B点生成物化学式是:Fe3O4。
,则得出B点生成物化学式是:Fe3O4。