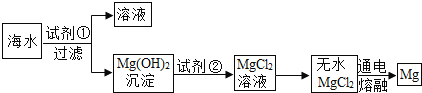
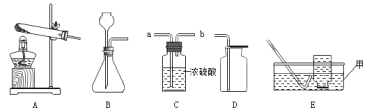
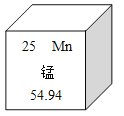
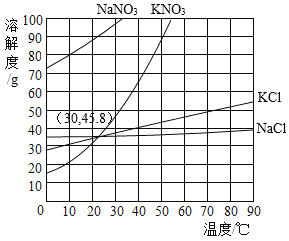
题目内容
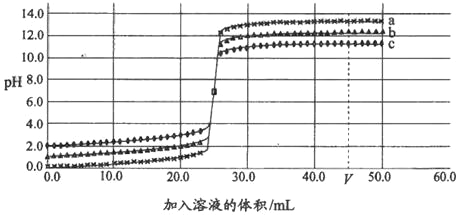
【题目】如图为三种不同浓度的氢氧化钠溶液与对应浓度的盐酸反应的曲线。
下列说法正确的是( )
A. 在a曲线所示的实验中,若用酚酞做指示剂,酚酞溶液由红色变为无色
B. 在a,b,c三种曲线所示的实验中,反应速率相同
C. 在a,b,c三种曲线所示的实验中,溶液酸性由强到弱的顺序是a>b>c
D. 在a,b,c三种曲线所示的实验中,所用盐酸浓度越大,V时所得溶液的pH越大
【答案】D
【解析】
A、图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH增大,是向盐酸中加入氢氧化钠溶液,在a曲线所示的实验中,若用酚酞做指示剂,酚酞溶液由无色变为红色,故选项说法错误。
B、在a、b、c三种曲线所示的实验中,由于反应物浓度不同,反应速率不相同,故选项说法错误。
C、在a、b、c三种曲线中,最终a、b、c都显碱性,故选项说法错误。
D、由图可以看出是向盐酸中加入氢氧化钠溶液,在a、b、c三种曲线所示的实验中,恰好完全反应,即pH=7时,需要氢氧化钠溶液体积相等,因此所用盐酸浓度越大,需要加入的氢氧化钠溶液浓度也越大,V时氢氧化钠溶液过量,所得溶液的pH越大,故选项说法正确。
故选:D。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案【题目】铁的化学性质比较活泼,能与氧气、酸、CuSO4溶液等多种物质发生化学反应。化学兴趣小组在课外资料中发现,铁和Fe2O3在高温条件下竟然也能发生化学反应。
(提出问题)
铁和Fe2O3反应的产物是什么?
(查阅资料)
①FeO、Fe2O3、Fe3O4中,Fe2O3是红棕色,其余是黑色;FeO在空气中会很快被氧化成Fe2O3;Fe3O4有磁性。②二氧化碳可用作该反应的保护气。③铁的氧化物都能与酸溶液反应。
(猜想与假设)
根据质量守恒定律,请你猜想铁和Fe2O3反应的产物:
①有FeO;②只有Fe3O4;③__________。
(进行实验)
(1)按下图装好药品(铁粉过量),连好仪器(装入药品前已检查装置的气密性)。
(2)轻推注射器活塞通入二氧化碳,估计玻璃管里空气________,停止通入二氧化碳。
(3)点燃酒精喷灯加热药品,等到固体粉末全部变黑,再熄灭酒精喷灯。
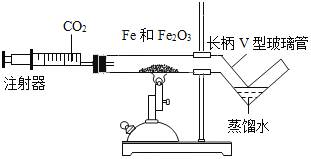
(4)当长柄V形玻璃管冷却至室温时,检验黑色粉末成分。检验过程如下(请填写表格中的空白):
检验操作及现象 | 检验结果 | |
a | 黑色粉末暴露在空气中不变化 | 黑色粉末中一定没有___________ |
b | 用磁铁靠近,黑色粉末能完全被吸引 | 黑色粉末中一定含有铁和_______ |
c | 取少量的黑色粉末装入试管,滴加足量的___________溶液,出现红色固体,充分反应后仍残留少许黑色粉末 | 确认猜想_______正确 |
(探究结论)
铁和Fe2O3能发生化合反应,有关的化学方程式是________________。
(反思评价)
本实验中的保护气,既能用二氧化碳气体,也能用________________。
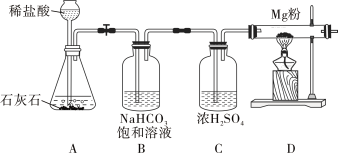
【题目】在学习盐酸的化学性质时,甲、乙两位同学分别做了稀盐酸和碳酸钠溶液反应的实验(如图1)。
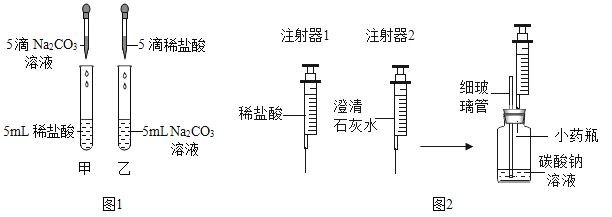
(实验现象)甲同学的实验中溶液有气泡冒出,乙同学的实验中溶液无气泡冒出。
(1)写出甲同学实验的化学反应方程式:_____________。
(提出问题)乙同学的实验中溶液为什么没有气泡冒出?
(查阅资料)碳酸钠和稀盐酸反应不仅可以生成二氧化碳还可以生成碳酸氢钠
(实验)同学们设计并进行了如图2所示的实验(装置气密性良好)。
实验编号 | 实验步骤 | 实验现象 |
① | Ⅰ.用注射器1向小药瓶中缓慢注入少量的稀盐酸,边注入边振荡 | 细玻璃管中液柱略微升高 |
Ⅱ.换注射器2从瓶中缓慢抽取气体 | 澄清石灰水无明显变化 | |
② | Ⅰ.用注射器1向小药瓶中继续注入稀盐酸至较多气泡产生 | |
Ⅱ.换注射器2从瓶中缓慢抽取气体 | 澄清石灰水变浑浊 |
(2)细玻璃管在实验中的主要作用是________;实验①中细玻璃管中液柱略微升高的原因___________。
(3)实验②中Ⅰ的现象是_________;实验①、②中步骤Ⅱ:注射器2必须缓慢地从瓶中抽取气体的原因是_________________。
(实验反思)此反应说明反应物的量不同,产物可能不同,试另举一例:____________。
(若正确回答下列问题加4分,总分不超过60分)
在老师的帮助下,同学们利用pH传感器对相同浓度的碳酸钠溶液(pH为12)、碳酸氢钠溶液(pH为8.2)与稀盐酸反应时,pH的变化与盐酸体积的关系进行了测定,并做了如下所示的对比图:
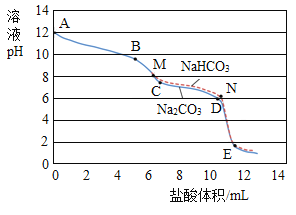
图中各线段实验现象如下表:
溶液 | 线段 | 实验现象 |
Na2CO3 | AB | 无气泡 |
BC | 有少量气泡 | |
CD | 有大量气泡 | |
DE | 几乎无气泡 | |
NaHCO3 | MN | 立即有大量气泡 |
NE | 几乎无气泡 |
(4)在AB段,溶液中的溶质有_________。
(5)分析图表,体现碳酸钠与稀盐酸反应分两步:
第一步反应:Na2CO3+HCl=NaCl+NaHCO3
第二步反应的化学方程式为:__________。