题目内容
【题目】实验室保存有一瓶淡黄色固体药品,标签上的药品名称为“过氧化钠(Na2O2)”,但是已经过了保质期。某化学兴趣小组想知道这瓶固体究竟含有哪些物质。他们在老师的指导下进行了实验探究,请你完成兴趣小组的下列实验报告。
(查阅资料)
Ⅰ.过氧化钠是一种淡黄色固体,常用在呼吸面具和潜艇中制造氧气。其原理是:2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O═4NaOH+O2↑
Ⅱ.常温常压下,O2和CO2的密度分别为1.3g/L、1.8g/L。
(分析猜想)
(1)该小组同学认为,不用做实验,仅由查得的资料和所学知识就可推断该固体一定含有Na2O2.理由是_____。
(2)进一步对固体成分提出以下猜想:
Ⅰ.只有Na2O2;Ⅱ.含有Na2O2和Na2CO3两种物质;
Ⅲ.含有_____两种物质;Ⅳ.含有_____。
(实验操作)
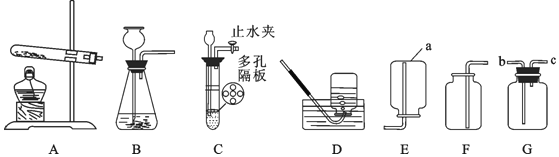
首先按如图连接好装置。用电子秤称取 1.00g 固体样品置于干燥的仪器 X 中,向分液漏斗中加入一定量的蒸馏水。
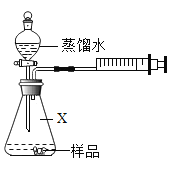
(3)仪器X的名称是_____。打开分液漏斗活塞,将蒸馏水加入仪器X中。反应完全后(无固体剩余),注射器内收集到80.0mL气体,说明样品中含有_____g Na2O2(计算结果保留到小数点后两位)。
(4)更换注射器后,再通过分液漏斗向仪器X 中加入足量稀盐酸,溶液中出现气泡,最终注射器内收集气体的质量为 0.11g。由此可知,样品中含有_____,该物质的质量为_____(计算结果保留到小数点后两位)。
(得出结论)
(5)通过以上实验操作得出结论,猜想_____是正确的(填序号)。
【答案】过氧化钠是淡黄色固体,而氢氧化钠和碳酸钠都是白色固体 Na2O2、NaOH; Na2O2、NaOH、Na2CO3 锥形瓶; 0.51。 碳酸钠; 0.27g Ⅳ
【解析】
(1)不要做实验,仅由查得的资料和所学知识就可推断该固体一定含有Na2O2,理由是过氧化钠是淡黄色固体,而氢氧化钠和碳酸钠都是白色固体;
(2)根据“2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O═4NaOH+O2↑”和质量守恒定律,进一步对固体成分提出以下猜想:
Ⅰ.只有Na2O2;
Ⅱ.含有Na2O2和Na2CO3两种物质;
Ⅲ.含有Na2O2、NaOH两种物质;
Ⅳ.含有Na2O2、NaOH、Na2CO3。
(3)仪器X的名称是锥形瓶;
反应完全后(无固体剩余),注射器内收集到80.0mL气体,该气体是氧气,氧气质量为:1.3g/L×0.08L=0.104g,
设:过氧化钠的质量为x。
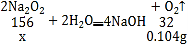
![]() x=0.51g;
x=0.51g;
(4)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,再通过分液漏斗向仪器锥形瓶加入足量稀盐酸,溶液中出现气泡,说明样品中含有碳酸钠;最终注射器内收集气体的质量为0.11g,即碳酸钠和稀盐酸反应生成了0.11g二氧化碳,
设:碳酸钠质量为y。

![]() y=0.27g;
y=0.27g;
(5)药品中含有氢氧化钠质量为:1.00g﹣0.51g﹣0.27g=0.22g,即药品中含有过氧化钠、氢氧化钠、碳酸钠,猜想Ⅳ是正确的。