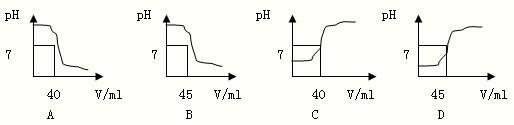
题目内容
小明家购买了一瓶白醋,标签上注明醋酸的质量分数≥5%.小明想,这瓶白醋中醋酸的含量是否与标签的标注相符?小明于是用有关酸碱的知识做了如下实验:实验步骤①先用量筒取12mL白醋(密度近似为1.0g/mL)倒入烧杯中,再加入20mL蒸馏水稀释.②量取45.0mL溶质质量分数为1.0%(密度近似为1.0g/mL)的氢氧化钠溶液,逐滴的滴加到稀释后的白醋中,同时不断搅拌烧杯中的溶液.滴至恰好完全反应,剩余氢氧化钠溶液5.0mL.(反应原理:CH3COOH+NaOH═CH3COONa+H2O )
请问:(1)CH3COOH中C、H、O的原子个数比为:______;
(2)该瓶白醋中溶质的质量分数为多少?
解:(1)利用化学式中原子的个数关系解决:故答案为:1:2:1
(2)解:由题知,实际参加反应的氢氧化钠质量为:(45.0-5.0)mL×1.0g/mL×1.0%=0.4g
设该瓶白醋中溶质的质量分数为x
CH3COOH+NaOH═CH3COONa+H2O
60 40
x 0.4g
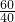 =
=
x=0.6g
则醋酸的溶质质量分数是: ×100%=5%
×100%=5%
答:该瓶白醋中溶质的质量分数为5%.
分析:(1)利用化学式中各原子的个数比等于各元素符号右下角角码的比,求解时要注意一个化学式中各元素原子的分布.
(2)首先计算出反应时氢氧化钠的质量,再利用化学方程式进行已知一个反应物求另一个反应物的计算.
点评:此题是对醋酸有关知识的考查,涉及到醋酸分子的意义及常规的化学方程式的计算,计算的形式是已知一个反应物求另一个反应物.
(2)解:由题知,实际参加反应的氢氧化钠质量为:(45.0-5.0)mL×1.0g/mL×1.0%=0.4g
设该瓶白醋中溶质的质量分数为x
CH3COOH+NaOH═CH3COONa+H2O
60 40
x 0.4g
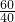 =
=
x=0.6g
则醋酸的溶质质量分数是:
 ×100%=5%
×100%=5%答:该瓶白醋中溶质的质量分数为5%.
分析:(1)利用化学式中各原子的个数比等于各元素符号右下角角码的比,求解时要注意一个化学式中各元素原子的分布.
(2)首先计算出反应时氢氧化钠的质量,再利用化学方程式进行已知一个反应物求另一个反应物的计算.
点评:此题是对醋酸有关知识的考查,涉及到醋酸分子的意义及常规的化学方程式的计算,计算的形式是已知一个反应物求另一个反应物.

练习册系列答案
相关题目
小明家购买了一瓶白醋,标签上注明醋酸的质量分数≥5%.小明想,这瓶白醋中醋酸的含量是否与标签的标注相符?请你与小明一起,用有关化学知识,定量测定白醋中醋酸的含量.
【提出问题】这瓶白醋中醋酸的含量是否与标签的标注相符?
【实验原理】
(1)醋酸属于 (“有机”或“无机”)酸,能与 (填物质类别)发生中和反应.
(2)用已知浓度的氢氧化钠溶液和醋酸反应,反应的化学方程式为:
CH3COOH+NaOH=CH3COONa+H2O.
(3)在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加1滴氢氧化钠溶液,溶液就呈碱性,而1滴氢氧化钠溶液约为0.05mL,对测定结果的影响很小,可忽略不计.
【实验步骤】
(1)用 取12.0mL白醋(密度近似为1.0g/mL),倒入烧杯中,再加入20mL蒸馏水稀释.
(2)量取45.0mL溶质质量分数为1.0%的氢氧化钠溶液(密度近似为1.0g/mL),用胶头滴管吸取该氢氧化钠溶液,逐滴地滴加 到稀释后的白醋中,同时不断地搅拌烧杯中的溶液.滴至恰好完全反应,剩余氢氧化钠溶液5.0mL.
【交流反思】
(1)在实验步骤(1)中,加适量水稀释白醋,对实验结果 (填“有”或“无”)影响.为什么? .
(2)在实验步骤(2)中,小明如何确定醋酸和氢氧化钠已完全中和?
【解释与结论】
根据实验数据,通过计算,判断这瓶白醋中醋酸的含量 (“是”或“否”)与标签的标注相符.
【提出问题】这瓶白醋中醋酸的含量是否与标签的标注相符?
【实验原理】
(1)醋酸属于
(2)用已知浓度的氢氧化钠溶液和醋酸反应,反应的化学方程式为:
CH3COOH+NaOH=CH3COONa+H2O.
(3)在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加1滴氢氧化钠溶液,溶液就呈碱性,而1滴氢氧化钠溶液约为0.05mL,对测定结果的影响很小,可忽略不计.
【实验步骤】
(1)用
(2)量取45.0mL溶质质量分数为1.0%的氢氧化钠溶液(密度近似为1.0g/mL),用胶头滴管吸取该氢氧化钠溶液,逐滴地滴加
【交流反思】
(1)在实验步骤(1)中,加适量水稀释白醋,对实验结果
(2)在实验步骤(2)中,小明如何确定醋酸和氢氧化钠已完全中和?
| 实验操作 | 实验现象 | 结论 |
根据实验数据,通过计算,判断这瓶白醋中醋酸的含量