题目内容
小明家购买了一瓶白醋,标签上注明醋酸的质量分数≥5%.小明想,这瓶白醋中醋酸的含量是否与标签的标注相符?请你与小明一起,用有关化学知识,定量测定白醋中醋酸的含量.【提出问题】这瓶白醋中醋酸的含量是否与标签的标注相符?
【实验原理】
(1)醋酸属于
(2)用已知浓度的氢氧化钠溶液和醋酸反应,反应的化学方程式为:
CH3COOH+NaOH=CH3COONa+H2O.
(3)在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加1滴氢氧化钠溶液,溶液就呈碱性,而1滴氢氧化钠溶液约为0.05mL,对测定结果的影响很小,可忽略不计.
【实验步骤】
(1)用
(2)量取45.0mL溶质质量分数为1.0%的氢氧化钠溶液(密度近似为1.0g/mL),用胶头滴管吸取该氢氧化钠溶液,逐滴地滴加
【交流反思】
(1)在实验步骤(1)中,加适量水稀释白醋,对实验结果
(2)在实验步骤(2)中,小明如何确定醋酸和氢氧化钠已完全中和?
| 实验操作 | 实验现象 | 结论 |
根据实验数据,通过计算,判断这瓶白醋中醋酸的含量
分析:(1)醋酸是一种含有有机酸酸根的酸,与碱能发生中和反应.
【实验步骤】量取一定体积的液体一般用量筒量取.
【交流与反思】】(1)加水稀释时溶质的质量不变,并不会影响实验的结果.
(2)利用酚酞作指示剂鉴定反应是否恰好进行.
【数据处理】已知的量是氢氧化钠的质量,需求的是醋酸的质量,根据化学方程式的计算解决.
【实验步骤】量取一定体积的液体一般用量筒量取.
【交流与反思】】(1)加水稀释时溶质的质量不变,并不会影响实验的结果.
(2)利用酚酞作指示剂鉴定反应是否恰好进行.
【数据处理】已知的量是氢氧化钠的质量,需求的是醋酸的质量,根据化学方程式的计算解决.
解答:解:
【实验原理】醋酸是一种含有有机酸酸根的酸,应属于有机酸,与碱能发生中和反应.
故答案为:有机;碱类
【实验步骤】液体体积的量取一般是使用量筒完成.滴加时主要是滴加碱液到醋酸中.
故答案为:量筒;氢氧化钠溶液.
【交流反思】
(1)因为实验的目的是测定醋酸的质量,加水稀释时溶质的质量不变,并不会影响实验的结果.
故答案为:无;稀释前后溶质质量不变.
(2)利用酚酞作指示剂鉴定反应是否恰好进行,开始反应时醋酸与氢氧化钠反应,溶液呈中性,酚酞无色,至恰好反应再滴加一滴氢氧化钠溶液会呈碱性酚酞会变红,
故答案为:
(2)在实验步骤(2)中,小明如何确定醋酸和氢氧化钠已完全中和?
【数据处理】
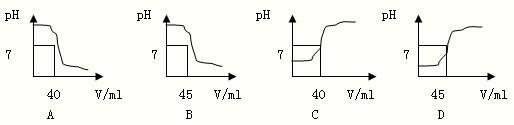
参加反应的氢氧化钠的质量为:(45mL-5mL)×1.0g/ml×1.0%═0.4g
设12g白醋中含醋酸的质量为x
CH3COOH+NaOH═CH3COONa+H2O
60 40
x 0.4g
=
x=0.6g
则白醋中醋酸的质量分数为:
×100%═5.0%
故答案为:是.
【实验原理】醋酸是一种含有有机酸酸根的酸,应属于有机酸,与碱能发生中和反应.
故答案为:有机;碱类
【实验步骤】液体体积的量取一般是使用量筒完成.滴加时主要是滴加碱液到醋酸中.
故答案为:量筒;氢氧化钠溶液.
【交流反思】
(1)因为实验的目的是测定醋酸的质量,加水稀释时溶质的质量不变,并不会影响实验的结果.
故答案为:无;稀释前后溶质质量不变.
(2)利用酚酞作指示剂鉴定反应是否恰好进行,开始反应时醋酸与氢氧化钠反应,溶液呈中性,酚酞无色,至恰好反应再滴加一滴氢氧化钠溶液会呈碱性酚酞会变红,
故答案为:
(2)在实验步骤(2)中,小明如何确定醋酸和氢氧化钠已完全中和?
| 实验操作 | 实验现象 | 结论 |
| 向1.0%的NaOH溶液中加入1-2滴酚酞 | 当最后一滴NaOH溶液落入使烧杯中红色不再褪去 | 醋酸与氢氧化钠恰好完全反应 |
参加反应的氢氧化钠的质量为:(45mL-5mL)×1.0g/ml×1.0%═0.4g
设12g白醋中含醋酸的质量为x
CH3COOH+NaOH═CH3COONa+H2O
60 40
x 0.4g
| 60 |
| 40 |
| x |
| 0.4g |
x=0.6g
则白醋中醋酸的质量分数为:
| 0.6g |
| 12mL×1g/mL |
故答案为:是.
点评:此题是一道醋酸含量的探究题,利用题目所给的信息,结合日常所学即可解决问题,其中的数据处理是已知一个反应物求另一个反应物的计算,是化学方程式的基本计算类型.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目