题目内容
某化学兴趣小组同学在帮忙整理化学药品室时发现一瓶标签部分残缺的药品,标签上依稀可见“电石”、“工业品”、“日期:2006”字样.打开瓶盖一看,发现瓶内装的是一些白色粉状和块状固体混合物.在老师指导下,兴趣小组同学对这瓶药品展开探究.
【查阅资料】(1)电石的成分主要是碳化钙(CaC2),工业品为灰黑色块状物.电石遇水立即发生激烈反应,生成乙炔(C2H2),并放出热量,实验室可用电石和水制取少量乙炔.有关反应方程式:
CaC2+2H2O═Ca(OH)2+C2H2
(2)乙炔微溶于水,能在氧气中燃烧,乙炔在氧气中燃烧温度可达3600度,可用于焊接或切割金属.
【提出问题】(1)实验室如何用电石和水制取少量乙炔?乙炔在氧气中完全燃烧的产物是什么?
(2)这瓶电石是否变质了?
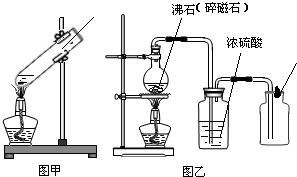
实验Ⅰ:用电石和水制取少量乙炔并验证乙炔在氧气中完全燃烧的产物,如图是实验室制取气体的部分实验装置图.请根据要求回答下列问题:
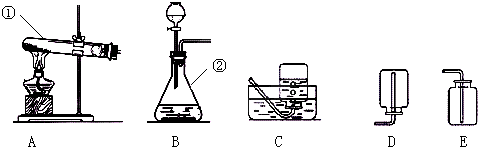
(1)写出图中带序号仪器的名称:①
(2)可用制取少量乙炔的反应装置是
(3)实验时,发现制取乙炔的反应十分剧烈,此时应进行的操作是
a.控制液体的滴加速度 b.改用体积小的锥形瓶 c.用长颈漏斗代替分液漏斗
(4)用A装置可制取的气体是
(5)在点燃乙炔之前,应进行的操作步骤是
实验Ⅱ:检验这瓶电石是否变质
(1)取少量试剂瓶内的白色粉状固体于试管中,加少量水,没有明显现象;取少量试剂瓶内的块状固体于试管中,加少量水,立即产生大量气泡,说明这瓶电石
(2)分析了电石变质的可能原因后,兴趣小组同学认为试剂瓶内的白色粉状固体可能是氢氧化钙,也可能是碳酸钙,还有可能是氢氧化钙和碳酸钙的混合物.请你帮他们完成实验报告.
(3)通过上述实验探究,说明电石暴露在空气中容易与
【查阅资料】(1)电石的成分主要是碳化钙(CaC2),工业品为灰黑色块状物.电石遇水立即发生激烈反应,生成乙炔(C2H2),并放出热量,实验室可用电石和水制取少量乙炔.有关反应方程式:
CaC2+2H2O═Ca(OH)2+C2H2
(2)乙炔微溶于水,能在氧气中燃烧,乙炔在氧气中燃烧温度可达3600度,可用于焊接或切割金属.
【提出问题】(1)实验室如何用电石和水制取少量乙炔?乙炔在氧气中完全燃烧的产物是什么?
(2)这瓶电石是否变质了?
实验Ⅰ:用电石和水制取少量乙炔并验证乙炔在氧气中完全燃烧的产物,如图是实验室制取气体的部分实验装置图.请根据要求回答下列问题:

(1)写出图中带序号仪器的名称:①
试管
试管
;②锥形瓶
锥形瓶
.(2)可用制取少量乙炔的反应装置是
B
B
(填符号).该反应装置还可用于制取二氧化碳
二氧化碳
,收集该气体的装置可用E
E
(填符号),有关化学方程式是CaCO3+2HCl═CaCl2+CO2↑+H2O
CaCO3+2HCl═CaCl2+CO2↑+H2O
.(3)实验时,发现制取乙炔的反应十分剧烈,此时应进行的操作是
ac
ac
(填符号).a.控制液体的滴加速度 b.改用体积小的锥形瓶 c.用长颈漏斗代替分液漏斗
(4)用A装置可制取的气体是
用高锰酸钾加热制取氧气
用高锰酸钾加热制取氧气
,有关化学方程式是2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.
| ||
(5)在点燃乙炔之前,应进行的操作步骤是
检验乙炔的纯度
检验乙炔的纯度
.点燃乙炔时火焰明亮,把用澄清石灰水荡洗过的小烧杯罩在火焰上方,烧杯内壁有白色固体出现,把冷且干燥的小烧杯罩在火焰上方,烧杯内壁出现水雾.已知乙炔完全燃烧产物只有两种,则上述实验过程中涉及的有关化学方程式是2C2H2+5O2
4CO2+2H2O
| ||
2C2H2+5O2
4CO2+2H2O
、
| ||
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
.实验Ⅱ:检验这瓶电石是否变质
(1)取少量试剂瓶内的白色粉状固体于试管中,加少量水,没有明显现象;取少量试剂瓶内的块状固体于试管中,加少量水,立即产生大量气泡,说明这瓶电石
有
有
填“有”或“没有”)变质.(2)分析了电石变质的可能原因后,兴趣小组同学认为试剂瓶内的白色粉状固体可能是氢氧化钙,也可能是碳酸钙,还有可能是氢氧化钙和碳酸钙的混合物.请你帮他们完成实验报告.
| 实验操作步骤 | 实验现象 | 实验结论 |
| ①取样品于试管中,加入适量水,充分振荡后静置并滴加几滴无色酚酞 ②或取样品于试管中,加入适量的稀盐酸 |
①试管中的液体呈红色 ② 没有气泡冒出 没有气泡冒出 |
①样品中含有: 氢氧化钙 氢氧化钙 ②样品中不含有碳酸钙. |
水蒸气
水蒸气
反应而变质,因此,保存电石时应保持干燥
保持干燥
注意密封
密封
保存.分析:实验Ⅰ:(1)根据常见仪器的名称和用途进行解答;
(2)根据用电石和水制取少量乙炔以及二氧化碳能溶于水和密度大于空气的密度进行解答;
(3)根据控制水的量和滴加速度可以减缓反应的剧烈程度进行解答;
(4)根据装置A适用于反应物是固体,条件需要加热的反应进行解答;
(5)根据乙炔属于可燃性气体,遇明火可能会发生爆炸以及乙炔燃烧生成水和二氧化碳、二氧化碳能使澄清石灰水变浑浊进行解答;
实验Ⅱ:(1)根据电石遇水立即发生激烈反应,生成乙炔进行解答;
(2)根据氢氧化钙溶于水后形成的溶液呈碱性,能使酚酞试液变红以及碳酸钙和盐酸反应生成二氧化碳气体进行解答;
(3)根据电石变质生成氢氧化钙说明电石暴露在空气中容易与水蒸气反应而变质进行解答.
(2)根据用电石和水制取少量乙炔以及二氧化碳能溶于水和密度大于空气的密度进行解答;
(3)根据控制水的量和滴加速度可以减缓反应的剧烈程度进行解答;
(4)根据装置A适用于反应物是固体,条件需要加热的反应进行解答;
(5)根据乙炔属于可燃性气体,遇明火可能会发生爆炸以及乙炔燃烧生成水和二氧化碳、二氧化碳能使澄清石灰水变浑浊进行解答;
实验Ⅱ:(1)根据电石遇水立即发生激烈反应,生成乙炔进行解答;
(2)根据氢氧化钙溶于水后形成的溶液呈碱性,能使酚酞试液变红以及碳酸钙和盐酸反应生成二氧化碳气体进行解答;
(3)根据电石变质生成氢氧化钙说明电石暴露在空气中容易与水蒸气反应而变质进行解答.
解答:解:实验Ⅰ:(1)图中带序号仪器的名称:①试管;②锥形瓶;故填:试管;锥形瓶;
(2)用电石和水制取少量乙炔,反应物的状态为固体和液体,条件不需要加热,所以制取少量乙炔的反应装置是B;该反应装置还可用于石灰石和稀盐酸反应制取二氧化碳;二氧化碳能溶于水和密度大于空气的密度,所以收集该气体的装置可用E;故填:B;二氧化碳;E;CaCO3+2HCl═CaCl2+CO2↑+H2O;
(3)控制水的量和滴加速度可以减缓反应的剧烈程度,所以实验时,发现制取乙炔的反应十分剧烈,此时应进行的操作是控制液体的滴加速度用长颈漏斗代替分液漏斗,而改用体积小的锥形瓶对于减缓反应的剧烈程度无关;故填:ac;
(4)装置A适用于反应物是固体,条件需要加热的反应,所以可用高锰酸钾加热制取氧气,高锰酸钾加热生成锰酸钾、二氧化锰和氧气,方程式是2KMnO4
K2MnO4+MnO2+O2↑;故填:用高锰酸钾加热制取氧气;2KMnO4
K2MnO4+MnO2+O2↑;
(5)乙炔属于可燃性气体,遇明火可能会发生爆炸,所以在点燃乙炔之前,应进行的操作步骤是检验乙炔的纯度;乙炔燃烧生成水和二氧化碳、二氧化碳能使澄清石灰水变浑浊,有关化学方程式是2C2H2+5O2
4CO2+2H2O、CO2+Ca(OH)2=CaCO3↓+H2O;故填:检验乙炔的纯度;2C2H2+5O2
4CO2+2H2O;CO2+Ca(OH)2=CaCO3↓+H2O;
实验Ⅱ:(1)电石遇水立即发生激烈反应,生成乙炔,而取少量试剂瓶内的白色粉状固体于试管中,加少量水,没有明显现,说明电石已经变质;故填:有;
(2)氢氧化钙溶于水后形成的溶液呈碱性,能使酚酞试液变红,碳酸钙和盐酸反应生成二氧化碳气体;故答案为:
;
(3)电石变质生成氢氧化钙说明电石暴露在空气中容易与水蒸气反应而变质,所以保存电石时应保持干燥注意密封保存.故填:水蒸气;保持干燥;密封.
(2)用电石和水制取少量乙炔,反应物的状态为固体和液体,条件不需要加热,所以制取少量乙炔的反应装置是B;该反应装置还可用于石灰石和稀盐酸反应制取二氧化碳;二氧化碳能溶于水和密度大于空气的密度,所以收集该气体的装置可用E;故填:B;二氧化碳;E;CaCO3+2HCl═CaCl2+CO2↑+H2O;
(3)控制水的量和滴加速度可以减缓反应的剧烈程度,所以实验时,发现制取乙炔的反应十分剧烈,此时应进行的操作是控制液体的滴加速度用长颈漏斗代替分液漏斗,而改用体积小的锥形瓶对于减缓反应的剧烈程度无关;故填:ac;
(4)装置A适用于反应物是固体,条件需要加热的反应,所以可用高锰酸钾加热制取氧气,高锰酸钾加热生成锰酸钾、二氧化锰和氧气,方程式是2KMnO4
| ||
| ||
(5)乙炔属于可燃性气体,遇明火可能会发生爆炸,所以在点燃乙炔之前,应进行的操作步骤是检验乙炔的纯度;乙炔燃烧生成水和二氧化碳、二氧化碳能使澄清石灰水变浑浊,有关化学方程式是2C2H2+5O2
| ||
| ||
实验Ⅱ:(1)电石遇水立即发生激烈反应,生成乙炔,而取少量试剂瓶内的白色粉状固体于试管中,加少量水,没有明显现,说明电石已经变质;故填:有;
(2)氢氧化钙溶于水后形成的溶液呈碱性,能使酚酞试液变红,碳酸钙和盐酸反应生成二氧化碳气体;故答案为:
| 实验操作步骤 | 实验现象 | 实验结论 |
| ①取样品于试管中,加入适量水,充分振荡后静置并滴加几滴无色酚酞 ②或取样品于试管中,加入适量的稀盐酸 |
①试管中的液体呈红色 ②没有气泡冒出 |
①样品中含有:氢氧化钙; ②样品中不含有碳酸钙. |
(3)电石变质生成氢氧化钙说明电石暴露在空气中容易与水蒸气反应而变质,所以保存电石时应保持干燥注意密封保存.故填:水蒸气;保持干燥;密封.
点评:本题考查了破损标签试剂的确定,完成此题,可以依据破损标签的部分已经有关物质的性质进行.要求同学们熟练掌握有关物质的性质,以便灵活应用.

练习册系列答案
相关题目
 .
. 铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.图1是稀释浓硫酸实验的示意图.
铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.图1是稀释浓硫酸实验的示意图. 已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.
已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.