��Ŀ����
����Ŀ���ƵĻ��������ճ�������Ӧ�ù㷺��
��1���Ȼ�������Ҫ�ĵ�ζƷ�����������ɵģ��Ȼ��ƿ���������������ȼ�յõ�����Ӧ�Ļ�ѧ����ʽΪ ��
��2��Ϊ�˼���ʵ���ұ���� NaOH �Ƿ���ʼ����������ijͬѧ���������ʵ�鷽�������о������ͼ�ش� 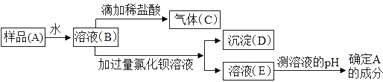
���������Ʊ��ʵ�ԭ�������û�ѧ����ʽ��ʾ��������ʵ����������Ϊ���������ƹ������ʣ���ѡ���δ������
��ʵ���м�������Ȼ�����Һ��Ŀ���� ��
��ʵ���вⶨ��Һ pH �ķ����� �� �������ҺE��pH��7������ƷA�ijɷ���
��3��ȡ�ѱ��ʵ�����������Ʒ���Ƴ� 100g ��Һ�������м���������������Ϊ 7.3%��ϡ���� 100g����ȫ��Ӧ��õ�������Һ 197.8g���Լ�����ȡ��Ʒ�����ʵ�������
���𰸡�
��1��Cl?�� Na+��2Na+Cl2 ![]() 2NaCl
2NaCl
��2��CO2+2NaOH=Na2CO3+H2O���ѣ���ȥ��Һ�е�Na2CO3���ò�����պȡ����Һ���ε����ڸ��ﲣ��Ƭ�ϵ�pH��ֽ�ϣ������ɫ���Ƚϣ���������Һ��pH��NaOH �� Na2CO3��
��3�����ɶ�����̼������Ϊ��100g+100g��197.8g=2.2g��
��μӷ�Ӧ��̼��������Ϊx
Na2CO3+ | 2HCl=2NaCl+H2O+ | CO2�� | |
106 | 44 | ||
x | 2.2g |
![]()
x=5.3g
���������⣺��1���Ȼ������������ӡ������ӹ��ɵģ��ƺ������ڵ�ȼ�������������Ȼ��ƣ���ѧ����ʽΪ��2Na+Cl2 ![]() 2NaCl����2���ٶ�����̼���������Ʒ�Ӧ����̼���ƺ�ˮ����ѧ����ʽΪ��CO2+2NaOH=Na2CO3+H2O����Һ�еμ�ϡ���ᣬ�����ݲ�����˵�����������Ѿ����ʣ����Ȼ�����̼���Ʒ�Ӧ������̼�ᱵ�������Ȼ��ƣ�����ʵ���м�������Ȼ�����Һ��Ŀ���dz�ȥ��Һ�е�Na2CO3����ʵ���вⶨ��ҺpH�ķ����ǣ��ò�����պȡ����Һ���ε����ڸ��ﲣ��Ƭ�ϵ�pH��ֽ�ϣ������ɫ���Ƚϣ���������Һ��pH���������ҺE��pH��7������ƷA�ijɷ���NaOH �� Na2CO3�� ���Դ��ǣ���1��Cl�� Na+ �� 2Na+Cl2
2NaCl����2���ٶ�����̼���������Ʒ�Ӧ����̼���ƺ�ˮ����ѧ����ʽΪ��CO2+2NaOH=Na2CO3+H2O����Һ�еμ�ϡ���ᣬ�����ݲ�����˵�����������Ѿ����ʣ����Ȼ�����̼���Ʒ�Ӧ������̼�ᱵ�������Ȼ��ƣ�����ʵ���м�������Ȼ�����Һ��Ŀ���dz�ȥ��Һ�е�Na2CO3����ʵ���вⶨ��ҺpH�ķ����ǣ��ò�����պȡ����Һ���ε����ڸ��ﲣ��Ƭ�ϵ�pH��ֽ�ϣ������ɫ���Ƚϣ���������Һ��pH���������ҺE��pH��7������ƷA�ijɷ���NaOH �� Na2CO3�� ���Դ��ǣ���1��Cl�� Na+ �� 2Na+Cl2 ![]() 2NaCl����2����CO2+2NaOH=Na2CO3+H2O���ѣ��ڳ�ȥ��Һ�е�Na2CO3�����ò�����պȡ����Һ���ε����ڸ��ﲣ��Ƭ�ϵ�pH��ֽ�ϣ������ɫ���Ƚϣ���������Һ��pH��NaOH �� Na2CO3����3��5.3g��
2NaCl����2����CO2+2NaOH=Na2CO3+H2O���ѣ��ڳ�ȥ��Һ�е�Na2CO3�����ò�����պȡ����Һ���ε����ڸ��ﲣ��Ƭ�ϵ�pH��ֽ�ϣ������ɫ���Ƚϣ���������Һ��pH��NaOH �� Na2CO3����3��5.3g��
�����㾫�������ڱ��⿼�����д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ���ݻ�ѧ��Ӧ����ʽ�ļ��㣬��Ҫ�˽�ע�⣺a����ƽ b������ c�����ţ������ʼ�������=ϵ������Է�������֮�Ȳ��ܵó���ȷ�𰸣�

 ��У����ϵ�д�
��У����ϵ�д�