��Ŀ����
����Ŀ��Ϊ���ij���ŷ���ˮ�е������ӵĺ�����������50g��������Ϊ5�����Ȼ�����Һ����ͼ��ijͬѧ������Һ�IJ�������.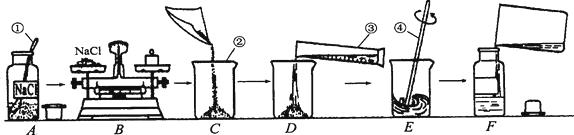
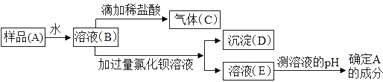
��1��д����Ţ١��ܸ����������ƣ����� ���� ���� ����
��2��A�����еĴ�����
��3��B������Ӧ�����Ȼ��Ƶ�������g������ʱ��ָ��ƫ��Ӧ���еIJ�������
��4��D�����������۵Ĺ��ӦΪ(�10����50����500��)mL.
��5��E���������� ��
��6�����д�������У����ܵ���������������ƫ�͵���(�����).
��B������������Ȼ��ƷŴ����� ��D������������ˮ����
��D���������Ӱ�Һ����ʹ�������F��������Һ����
���𰸡�
��1��ҩ�ף��ձ�����Ͳ��������
��2��ƿ��Ӧ������������
��3��2.5g��ȡ�������NaCl���壬ֱ����ƽƽ��
��4��50mL
��5�������Ȼ��ƹ����ܽ�
��6���٢�
����������(1)���������ƣ���Ϊ��ҩ�� �ձ� ��Ͳ ������(2)A�д���Ϊ��ƿ��Ӧ������������(3)���ʵ�����=��Һ�����������ʵ���������=50g��5%=2.5g������������ƽ��ԭ����m(����)=m(����)+m(����)��ָ��ƫ�������������ϴ��Ȼ��Ƶ�����ƫ�����Դ�Ϊ��2.5g ȡ�������NaCl���壬ֱ����ƽƽ��(4)�ܼ�ˮ������Ϊ50g-2.5g=47.5g��ͨ���ܶȿ������ˮ�����Ϊ47.5mL��ʹ��50mL����Ͳ��ȡ�����Դ�Ϊ��50mL(5)E����Ϊ���裬�����Ŀ���Ǽ����ܽ⣬���Դ�Ϊ�������Ȼ��ƹ����ܽ�(6)���ʵ�����ƫС����Һ������ƫ��ᵼ�����ʵ���������ƫС�������Ȼ�������ƫС.����ˮ������������Һ����ƫС.�����ܼ����ƫ����Һ����ƫ��.������Һ��������ɣ����������Ѷ�����Ӱ�죬���Դ�Ϊ���٢�