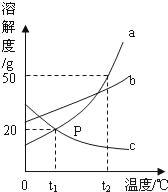
题目内容
【题目】Ba(NO3)2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO3、BaSO3、Fe2O3)可制取Ba(NO3)2,其部分流程加下:
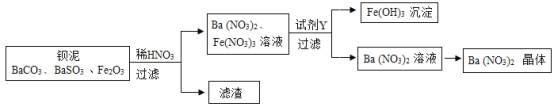
(1) Ba(NO3)2中钡元素的化合价为_____;流程中所涉及的氧化物_______(填1种即可)。
(2) BaCO3与HNO3反应的反应类型是______;写出Fe2O3与HNO3反应的化学方程式:_________
(3)试剂Y为_______(填序号)。
①BaCl2溶液②Ba(OH)2溶液 ③NaOH溶液
(4)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是_______________
【答案】+2 氧化铁(或二氧化碳) 复分解反应 Fe2O3+6HNO3= 2Fe(NO3)3+3H2O ② 蒸发结晶
【解析】
(1)NO3的化合价为-1价,设钡的化合价为x,根据化合物中各元素的化合价的代数和为零,则x+(-1)×2=0,x=+2,所以钡元素的化合价为+2,故填+2;
流程中所涉及的氧化物有氧化铁、二氧化碳等,故填氧化铁(或二氧化碳)。
(2)BaCO3与HNO3反应是盐与酸的反应,反应类型属于复分解反应,故填复分解反应;
氧化铁与稀硝酸与反应生成硝酸铁和水,故反应的化学方程式写为:Fe2O3+6HNO3= 2Fe(NO3)3+3H2O。
(3)根据流程图可知,硝酸铁与试剂Y反应生成硝酸钡和氢氧化铁沉淀,根据质量守恒定律推断Y是Ba(OH)2,故填②。
(4)使Ba(NO3)2 溶液中Ba(NO3)2全部析出形成晶体的方法是蒸发结晶,故填蒸发结晶。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目