题目内容
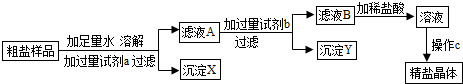
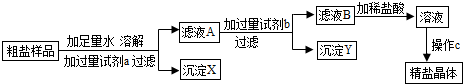
某粗盐溶液中,含有少量的氯化钙、氯化镁、硫酸钠和泥沙.进行以下操作可将杂质除去:①过滤;②加适量盐酸;③加过量氢氧化钠溶液;④加过量碳酸钠溶液;⑤加适量氯化钡溶液.正确的操作顺序是( )A.⑤④③①②
B.①②③④⑤
C.①⑤④②③
D.⑤③④②①
【答案】分析:根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去进行分析,
解答:解:A、加入适量的氯化钡溶液,可以将硫酸根离子转化为沉淀,加过量碳酸钠溶液,可以将钙离子和反应剩余的钡离子转化为沉淀,加过量氢氧化钠溶液,可以将镁离子转化为沉淀,过滤可以将沉淀和泥沙除去,加适量盐酸,可以除去反应剩余的碳酸根离子和氢氧根离子,最后的溶液中就只剩下了氯化钠和水,故A正确,
B、过滤只会将泥沙除去,而后面步骤中的沉淀是无法从溶液中除去的,故B错误,
C、过滤只会将泥沙除去,而后面步骤中生成的沉淀是无法从溶液中除去的,也就多达不到除杂的目的,故C错误,
D、加入适量的氯化钡溶液,可以将钡离子转化为沉淀,加过量氢氧化钠溶液,可以将镁离子转化为沉淀,加过量碳酸钠溶液,可以将钙离子和反应剩余的钡离子转化为沉淀.若先加入盐酸,会导致生成的沉淀溶解掉,所以本选项不能得到纯净氯化钠.故D错误.
故选A.
点评:在解此类题时,首先要知道除去的杂质的离子的性质,然后选择合适的试剂和滴加顺序进行除杂,一般加碳酸根离子要放在加钡离子之后,可以将剩余的钡离子除去,除杂的结果,最后只能首先氯化钠,也就是氯离子和钠离子.
解答:解:A、加入适量的氯化钡溶液,可以将硫酸根离子转化为沉淀,加过量碳酸钠溶液,可以将钙离子和反应剩余的钡离子转化为沉淀,加过量氢氧化钠溶液,可以将镁离子转化为沉淀,过滤可以将沉淀和泥沙除去,加适量盐酸,可以除去反应剩余的碳酸根离子和氢氧根离子,最后的溶液中就只剩下了氯化钠和水,故A正确,
B、过滤只会将泥沙除去,而后面步骤中的沉淀是无法从溶液中除去的,故B错误,
C、过滤只会将泥沙除去,而后面步骤中生成的沉淀是无法从溶液中除去的,也就多达不到除杂的目的,故C错误,
D、加入适量的氯化钡溶液,可以将钡离子转化为沉淀,加过量氢氧化钠溶液,可以将镁离子转化为沉淀,加过量碳酸钠溶液,可以将钙离子和反应剩余的钡离子转化为沉淀.若先加入盐酸,会导致生成的沉淀溶解掉,所以本选项不能得到纯净氯化钠.故D错误.
故选A.
点评:在解此类题时,首先要知道除去的杂质的离子的性质,然后选择合适的试剂和滴加顺序进行除杂,一般加碳酸根离子要放在加钡离子之后,可以将剩余的钡离子除去,除杂的结果,最后只能首先氯化钠,也就是氯离子和钠离子.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目