题目内容
某粗盐样品中含有杂质氯化镁、氯化钙、某同学设计了以下提纯方案:
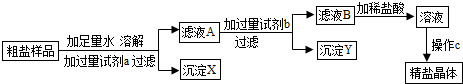
请回答下列问题:
(1)方案中加入过量试剂a若为氢氧化钠溶液,则其目的是为了除去粗盐中的
(2)在过滤操作中,除用到带铁圈的铁架台、烧杯、玻璃棒外,还需要用到的仪器是
(3)醒制50g溶质质量分数为6%的NaCl溶液,需NaCI
(4)向滤液B滴加稀盐酸的过程中,当观察到的溶液的现象为
(5)操作C的名称为
A.蒸发时有一些液体、固体溅出
B.从蒸发皿将所得食盐晶体转移称量时有一定量残留往玻璃棒上
C.提纯后所得精盐尚未完全干燥.
(6)工业上用电解饱和食盐水的方法可制取氢氧化钠、氢气、和氯气,写出反应的化学方程式

请回答下列问题:
(1)方案中加入过量试剂a若为氢氧化钠溶液,则其目的是为了除去粗盐中的
氯化镁
氯化镁
.(2)在过滤操作中,除用到带铁圈的铁架台、烧杯、玻璃棒外,还需要用到的仪器是
漏斗
漏斗
.(3)醒制50g溶质质量分数为6%的NaCl溶液,需NaCI
3
3
g,水47
47
ml.(4)向滤液B滴加稀盐酸的过程中,当观察到的溶液的现象为
刚刚无气泡产生
刚刚无气泡产生
时,应停止滴加,如果滴加的稀盐酸过量,对最后得到的精盐晶体的成分没有
没有
(填“有”或“没有”)影响.(5)操作C的名称为
蒸发
蒸发
;某同学所得精盐比其他同学明显要少,原因可能是AB
AB
.A.蒸发时有一些液体、固体溅出
B.从蒸发皿将所得食盐晶体转移称量时有一定量残留往玻璃棒上
C.提纯后所得精盐尚未完全干燥.
(6)工业上用电解饱和食盐水的方法可制取氢氧化钠、氢气、和氯气,写出反应的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
分析:(1)氢氧化钠和氯化镁反应能生成氢氧化镁沉淀和氯化钠;
(2)过滤时,用到的仪器有带铁圈的铁架台、烧杯、玻璃棒和漏斗;
(3)根据溶液质量、质量分数可以计算溶质质量和溶剂质量;
(4)盐酸易挥发,和碳酸钠反应能生成氯化钠、水和二氧化碳;
(5)操作不当,容易导致出现较大的误差;
(6)根据反应物、生成物、反应条件及其质量守恒定律可以书写化学方程式.
(2)过滤时,用到的仪器有带铁圈的铁架台、烧杯、玻璃棒和漏斗;
(3)根据溶液质量、质量分数可以计算溶质质量和溶剂质量;
(4)盐酸易挥发,和碳酸钠反应能生成氯化钠、水和二氧化碳;
(5)操作不当,容易导致出现较大的误差;
(6)根据反应物、生成物、反应条件及其质量守恒定律可以书写化学方程式.
解答:解:(1)加入过量氢氧化钠溶液的目的是为了除去粗盐中的氯化镁,因为氢氧化钠和氯化镁反应能生成氢氧化镁沉淀和氯化钠.
故填:氯化镁.
(2)在过滤操作中,除用到带铁圈的铁架台、烧杯、玻璃棒外,还需要用到的仪器是漏斗.
故填:漏斗.
(3)50g溶质质量分数为6%的NaCl溶液中,溶质质量为:50g×6%=3g,水的质量是:50g-3g=47g,水的密度是1g/ml,所以水的体积是:47g÷1g/ml47ml.
故填:3;47.
(4)向滤液B滴加稀盐酸的过程中,稀盐酸先和过量的氢氧化钠反应,氢氧化钠完全反应后,稀盐酸再和碳酸钠反应,当观察到刚刚无气泡产生时,说明稀盐酸恰好和碳酸钠完全反应;因为盐酸易挥发,即使盐酸过量,也不会影响精盐晶体的成分.
故填:刚刚无气泡产生;没有.
(5)操作C是蒸发,蒸发时有一些液体、固体溅出,从蒸发皿将所得食盐晶体转移称量时有一定量残留往玻璃棒上时,都能够使所得精盐比其他同学明显要少;而提纯后所得精盐尚未完全干燥则会使所得精盐比其他同学明显要多.
故填:蒸发;AB.
(6)电解饱和食盐水的化学方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑.
故填:2NaCl+2H2O
2NaOH+H2↑+Cl2↑.
故填:氯化镁.
(2)在过滤操作中,除用到带铁圈的铁架台、烧杯、玻璃棒外,还需要用到的仪器是漏斗.
故填:漏斗.
(3)50g溶质质量分数为6%的NaCl溶液中,溶质质量为:50g×6%=3g,水的质量是:50g-3g=47g,水的密度是1g/ml,所以水的体积是:47g÷1g/ml47ml.
故填:3;47.
(4)向滤液B滴加稀盐酸的过程中,稀盐酸先和过量的氢氧化钠反应,氢氧化钠完全反应后,稀盐酸再和碳酸钠反应,当观察到刚刚无气泡产生时,说明稀盐酸恰好和碳酸钠完全反应;因为盐酸易挥发,即使盐酸过量,也不会影响精盐晶体的成分.
故填:刚刚无气泡产生;没有.
(5)操作C是蒸发,蒸发时有一些液体、固体溅出,从蒸发皿将所得食盐晶体转移称量时有一定量残留往玻璃棒上时,都能够使所得精盐比其他同学明显要少;而提纯后所得精盐尚未完全干燥则会使所得精盐比其他同学明显要多.
故填:蒸发;AB.
(6)电解饱和食盐水的化学方程式为:2NaCl+2H2O
| ||
故填:2NaCl+2H2O
| ||
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.

练习册系列答案
相关题目





