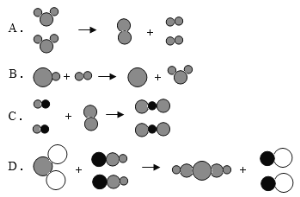
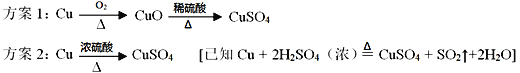题目内容
【题目】下列实验所对应的图像中不正确的是( )
A.  向NaOH溶液滴加足量的水
向NaOH溶液滴加足量的水
B. 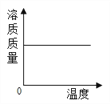 将一定质量硝酸钾饱和溶液升高温度
将一定质量硝酸钾饱和溶液升高温度
C. 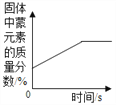 加热KClO3、MnO2混合物
加热KClO3、MnO2混合物
D. 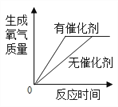 完全相同的过氧化氢溶液制氧气
完全相同的过氧化氢溶液制氧气
【答案】A
【解析】A、NaOH溶于水放出热量,随着水量的增加,NaOH溶液的温度应该是升高,图中所示温度降低,错误;B、硝酸钾的溶解度随着温度是升高而增加,则将一定质量硝酸钾和饱和溶液升高温度,无溶质析出,溶液中溶质的质量不变,与图中所示一致,正确;C、加热KClO3,MnO2混合物,有氧气生成, Mn的质量分数不断增大,一直到反应完毕,Mn的质量分数不再变化,与图中所示一致,正确;D、加入催化剂只改变反应速率而不改变氧气的质量,与图中所示一致,正确。故选A。

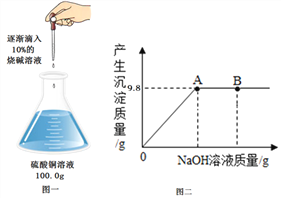
【题目】(6分)下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
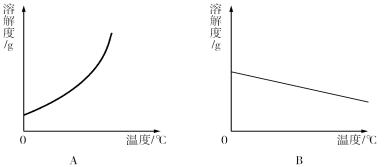
(1)依据上表数据,绘制了Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶度曲线的是 (填“A”或“B”);
(2)将一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙 ②升高温度 ③降低温度 ④加入水 ⑤蒸发水后再恢复到原温度 ⑥加入生石灰。
其中措施正确的是 ;
A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥
(3)20℃时,191g饱和NaOH溶液,蒸发10g水后,再恢复到20℃,可析出NaOH固体的质量为 ;
(4)现有20℃时Ca(OH)2的饱和溶液甲,向其中加入一定量CaO后得到溶液乙,此时溶液中溶质的质量
乙 甲(填“>”、“<”或“=”);
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH固体,应采取的物理方法是 ;
(6)20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH (填“偏大”、“偏小”或“不受影响”)。
【题目】化学活动小组围绕磷燃烧的化学反应,展开了如下探究活动:
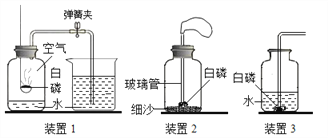
(1)空气中氧气含量的测定
① 表1实验记录
实验目的 | 空气中氧气含量的测量 |
实验装置 | 见装置1 |
现象(证据) | |
实验结论 | 氧气约占空气总体积的五分之一 |
则上表1中的“现象(证据)”栏目应填___________(可多选)。
A. 产生白雾 B. 放出热量 C. 产生五氧化二磷 D. 瓶内水面上升约1/5
② 同学们对该实验进行交流,你认为正确的是___________(可多选)
A. 改用放大镜聚光引燃会更合理
B. 铁丝燃烧产生固体Fe304,用铁丝代替白磷也能达到实验目的
C. 白磷(过量)燃烧熄灭后剩余气体主要是氮气,由此可看出氮气不燃烧,也不支持燃烧
D. 白磷燃烧结束后不能立即打开弹簧夹的原因是怕冷水进入集气瓶使集气瓶破裂
(2)验证质量守恒定律
①乙同学将装置1改装为装置2,为了验证质量守恒定律还需要的仪器是___________。
②调节仪器,称量整个装置的初始质量![]() ,将胶塞上的玻璃管在酒精灯上灼烧,迅速塞紧瓶塞,重新把装置进行称量,质量为
,将胶塞上的玻璃管在酒精灯上灼烧,迅速塞紧瓶塞,重新把装置进行称量,质量为![]() (不考虑气球带来的浮力)。实验结束之后,发现反应后质量减少(
(不考虑气球带来的浮力)。实验结束之后,发现反应后质量减少(![]() ),同学们分析原因如下,你认为正确的是___________(可多选)
),同学们分析原因如下,你认为正确的是___________(可多选)
A. 装置漏气 B. 白磷量不足 C. 气球破损 D. 没冷却到室温就称量
(3)燃烧条件的探究
丙同学用装置3进行燃烧条件的探究(白磷的着火点为40℃)设计了如下实验:
① 实验记录
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验操作 | 将白磷浸入40℃的热水 | 将白磷浸入40℃的热水,通入氧气 | 将白磷浸入冷水 中,通入氧气 |
实验现象 | 白磷不燃烧 | 白磷燃烧 | _______________ |
② 实验分析:对比_________和__________(填实验序号“Ⅰ”“Ⅱ”“Ⅲ”),可知可燃烧物燃烧的条件是温度达到着火点。
(4)探究活动(1)(2)(3)中共同的反应的化学方程式是________________________。