题目内容
【题目】学习盐的化学性质时,进行了如图所示的实验(提示:氯化钙、氯化钡的溶液都呈中性):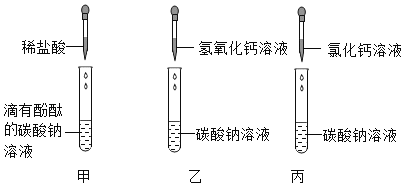
(1)碳酸钠是一种重要的盐,甲中碳酸钠溶液中加入酚酞,溶液显_____色;乙中发生反应的化学方程式是______________________。
(2)实验结束后,将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,过滤,得到滤液,滤液中一定不含有_______。
(3)对滤液中溶质进行探究。
(实验猜想)所得滤液中溶质可能为:
猜想一:NaCl、Na2CO3; 猜想二:NaCl、CaCl2
猜想三:NaCl、Na2CO3和NaOH; 猜想……
小明提出猜想二一定不成立,原因是_____________________________。
(实验设计)
实验操作 | 实验现象 | 实验结论 |
取少量滤液于试管中,加入过量BaCl2溶液 | ____________ | 猜想三成立 |
(实验分析)在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑_______。
【答案】红 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH HCl 反应后滤液显碱性,猜想二NaCl、CaCl2显中性与题意不相符。 有白色沉淀生成红色不褪去 未反应的反应物
【解析】
(1)碳酸钠溶液显碱性,碳酸钠溶液中加入酚酞,溶液显红色,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH故填:红;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
(2)实验结束后,将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,说明溶液显碱性,且沉淀为碳酸钙,故滤液中一定不含有HCl,因为盐酸与碱性物质和碳酸钙都能反应,不能共存,故填:HCl。
[实验猜想] 甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,说明溶液显碱性,猜想二溶液显中性,不符合题意,故填:反应后滤液显碱性,猜想二NaCl、CaCl2显中性与题意不相符。
[实验设计]猜想三成立滤液中有NaCl、Na2CO3和NaOH,加入过量BaCl2溶液氯化钡和碳酸钠生成碳酸钡沉淀,可以验证碳酸钠的存在并将碳酸钠除尽,滤液中还含有氢氧化钠,氢氧化钠显碱性,能使无色酚酞变色,故实验现象为:有白色沉淀生成,红色不褪去。
[实验分析] 在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑未反应的反应物,故填:未反应的反应物。

 优等生题库系列答案
优等生题库系列答案