题目内容
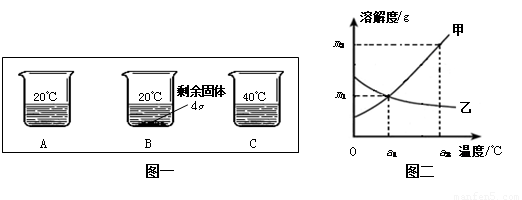
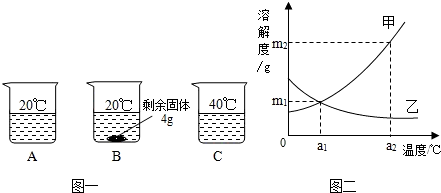
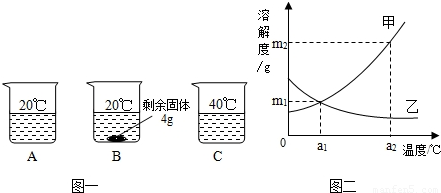
向分别装有50g水的A、B、C烧杯中加入10g、20g、30g的KNO3固体,充分溶解后,现象如图一所示:
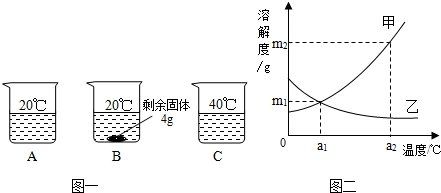
(1)A、B、C烧杯中溶液一定属于饱和溶液的是
(2)图二中
(3)KNO3在20℃时溶解度等于
(4)要使B烧杯中剩余固体继续溶解,可采用的方法是
(5)由图二分析,若分别将甲、乙100g的饱和溶液从a2℃降温到a1℃,无晶体析出的是
(6)若要使a1℃时含100g水的甲的饱和溶液变为a2℃的饱和溶液(溶剂的量不减少),应采取的措施为

(1)A、B、C烧杯中溶液一定属于饱和溶液的是
B
B
(选填序号).(2)图二中
甲
甲
(选填“甲”或“乙”)能表示KNO3溶解度曲线.(3)KNO3在20℃时溶解度等于
32g
32g
.(4)要使B烧杯中剩余固体继续溶解,可采用的方法是
加水(或“升高温度”)
加水(或“升高温度”)
;(5)由图二分析,若分别将甲、乙100g的饱和溶液从a2℃降温到a1℃,无晶体析出的是
乙
乙
(选填“甲”、“乙”或“甲和乙”),比较降温后所得溶液中溶质的质量分数甲>
>
乙(选填“>”或“<”或“=”).(6)若要使a1℃时含100g水的甲的饱和溶液变为a2℃的饱和溶液(溶剂的量不减少),应采取的措施为
加入(m2-m1)g固体甲,并升高温度至a2℃
加入(m2-m1)g固体甲,并升高温度至a2℃
(请依据图示作定量描述).分析:(1)在一定温度和溶剂中,有溶质析出的溶液中,溶质达到最大溶解能力,溶质不会溶解,则溶液一定为饱和溶液,没有固体析出的溶液可能是恰好饱和或不是饱和溶液.
(2)根据KNO3溶解度随温度的升高而增大进行解答;
(3)根据20℃时50g水最多溶解16g硝酸钾进行解答;
(4)根据KNO3溶解度随温度的升高而增大进行解答;
(5)根据甲、乙两物质的溶解度随温度的变化情况进行解答;
(6)根据甲物质的溶解度在a1℃为m1g、在a2℃为m2g进行解答.
(2)根据KNO3溶解度随温度的升高而增大进行解答;
(3)根据20℃时50g水最多溶解16g硝酸钾进行解答;
(4)根据KNO3溶解度随温度的升高而增大进行解答;
(5)根据甲、乙两物质的溶解度随温度的变化情况进行解答;
(6)根据甲物质的溶解度在a1℃为m1g、在a2℃为m2g进行解答.
解答:解:(1)B中有固体出现,一定是饱和溶液;
(2)KNO3溶解度随温度的升高而增大,所以图二中甲能表示KNO3溶解度曲线;
(3)根据20℃时50g水最多溶解16g硝酸钾,所以KNO3在20℃时溶解度等于32g;
(4)KNO3溶解度随温度的升高而增大,所以要使B烧杯中剩余固体继续溶解,可采用的方法是加水(或“升高温度”);
(5)甲物质的溶解度随温度的升高而增大,而乙物质的溶解度随温度的降低而增大,所以由图二分析,若分别将甲、乙100g的饱和溶液从a2℃降温到a1℃,无晶体析出的是乙;a1℃甲物质的溶解度大于a2℃乙物质的溶解度,所以降温后所得溶液中溶质的质量分数甲大于乙;
(6)甲物质的溶解度在a1℃为m1g、在a2℃为m2g,要使a1℃时含100g水的甲的饱和溶液变为a2℃的饱和溶液(溶剂的量不减少),应采取的措施为加入(m2-m1)g固体甲,并升高温度至a2℃.
故答案为:(1)B;(2)甲;(3)32g;(4)加水(或“升高温度”);(5)乙;>;(6)加入(m2-m1)g固体甲,并升高温度至a2℃.
(2)KNO3溶解度随温度的升高而增大,所以图二中甲能表示KNO3溶解度曲线;
(3)根据20℃时50g水最多溶解16g硝酸钾,所以KNO3在20℃时溶解度等于32g;
(4)KNO3溶解度随温度的升高而增大,所以要使B烧杯中剩余固体继续溶解,可采用的方法是加水(或“升高温度”);
(5)甲物质的溶解度随温度的升高而增大,而乙物质的溶解度随温度的降低而增大,所以由图二分析,若分别将甲、乙100g的饱和溶液从a2℃降温到a1℃,无晶体析出的是乙;a1℃甲物质的溶解度大于a2℃乙物质的溶解度,所以降温后所得溶液中溶质的质量分数甲大于乙;
(6)甲物质的溶解度在a1℃为m1g、在a2℃为m2g,要使a1℃时含100g水的甲的饱和溶液变为a2℃的饱和溶液(溶剂的量不减少),应采取的措施为加入(m2-m1)g固体甲,并升高温度至a2℃.
故答案为:(1)B;(2)甲;(3)32g;(4)加水(或“升高温度”);(5)乙;>;(6)加入(m2-m1)g固体甲,并升高温度至a2℃.
点评:本题考查了学生对饱和溶液的判断及饱和溶液与不饱和溶液的转化,应注意条件的变化来分析解答.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目