题目内容
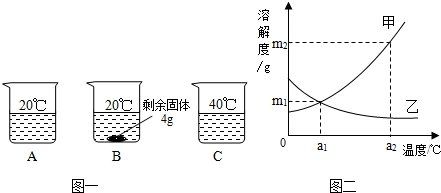
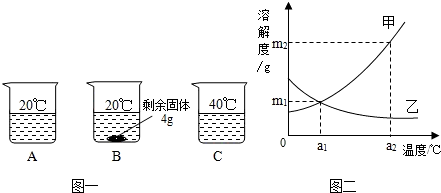
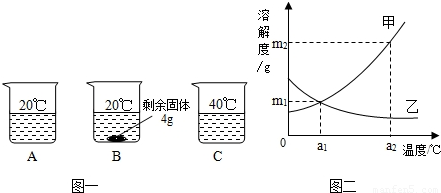
向分别装有50g水的A、B、C烧杯中加入10g、20g、30g的KNO3固体,充分溶解后,现象如图一所示:
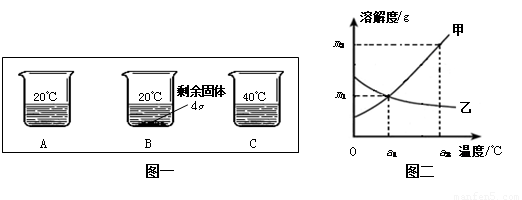
(1)A、B、C烧杯中溶液一定属于饱和溶液的是_______(选填序号)。
(2)图二中 (选填“甲”或“乙”)能表示KNO3溶解度曲线。
(3)KNO3在20℃时溶解度等于 。
(4)要使B烧杯中剩余固体继续溶解,可采用的方法是_________________________;
(5)由图二分析,若分别将甲、乙100g的饱和溶液从a2℃降温到a1℃,无晶体析出的是 (选填“甲”、 “乙”或“甲和乙”),比较降温后所得溶液中溶质的质量分数甲 乙(选填“>”或“<”或“=”)
(6)若要使a1℃时含100g水的甲的饱和溶液变为a2℃的饱和溶液(溶剂的量不减少),应采取的措施为 (请依据图示作定量描述)。
(1)B (2)甲 (3)32g (4)加水(或答“升高温度”) (5)乙 >
(6)加入(m2-m1)g固体甲,并升高温度至a2℃
【解析】
试题分析:(1)依据饱和溶液的概念可知,B烧杯中有固体未溶解,即在此温度下,不能继续溶解该物质,故一定是饱和溶液;
(2)由于硝酸钾的溶解度随温度的升高而增大,故曲线甲能表示KNO3溶解度曲线;
(3)根据题意,在盛有50g水的B烧杯中加入20g的KNO3固体,有4g未溶解,即在50g水中溶解了16gKNO3固体而达到饱和,故KNO3在20℃时的溶解度=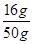 ×100g=32g;
×100g=32g;
(4)由于硝酸钾的溶解度随温度的升高而增大,所以要使B烧杯中的固体继续溶解,可采取的方法是升高温度或增加溶剂;
(5)根据溶解度曲线可知,将甲、乙100g的饱和溶液从a2℃降温到a1℃时,甲的溶解度减小,析出晶体;乙的溶解度增大,溶液变为不饱和溶液,故不会析出晶体;降温到a1℃时,由于有晶体析出,故甲仍是饱和溶液,其溶质质量分数= ×100%;温度从a2℃降温到a1℃时,由于乙变成不饱和溶液,故溶质质量分数小于
×100%;温度从a2℃降温到a1℃时,由于乙变成不饱和溶液,故溶质质量分数小于 ×100%,而a2℃时甲、乙的溶解度相等,所以可得出该温度时,所得溶液溶质质量分数甲大于乙;
×100%,而a2℃时甲、乙的溶解度相等,所以可得出该温度时,所得溶液溶质质量分数甲大于乙;
(6)由于甲物质的溶解度随温度的升高而增大,且a1℃时的溶解度为m1,a2℃时的溶解度为m2,故若要使a1℃时含100g水的甲的饱和溶液变为a2℃的饱和溶液(溶剂的量不减少),应采取的措施为:加入(m2-m1)g固体甲,并且升高温度至a2℃。
考点:饱和溶液与不饱和溶液,饱和溶液和不饱和溶液相互转变的方法,固体溶解度曲线及其作用,溶质的质量分数、溶解性和溶解度的关系
点评:本题难度不是很大,主要考查了固体溶解度曲线所表示的意义及根据溶解度曲线来解决相应的问题,解 题的关键是要熟记和理解固体溶解度曲线及其应用,并能灵活运用于实际问题的解答。