题目内容
碳化钙(化学式为CaCx)固体中含有杂质CaO,小组同学为测定CaCx中x的值进行如下图所示实验(已知CaCx在空气中灼烧生成CaO和CO2)。则下列推断正确的是
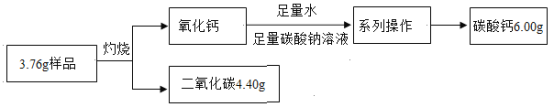
A.系列操作主要包括过滤、洗涤、干燥 B.CaCx中x的值为3
C.若碳酸钙未完全干燥,则所测x值偏小 D.该样品中氧、钙的质量比为2:5
练习册系列答案
相关题目
下列实验操作中能达到实验目的是( )
选项 | 实验目的 | 实验方案 |
A | 除去KNO3溶液中[Ba(NO3)2] | 滴加适量H2SO4溶液、过滤 |
B | 检验是否为二氧化碳气体 | 将燃着的木条伸入集气瓶中 |
C | 分离氧化铁粉末和碳粉的混合物 | 加入过量盐酸,过滤 |
D | 鉴别(NH4)2SO4固体和Na2SO4固体 | 分别加入熟石灰研磨,闻气味 |
A.A B.B C.C D.D


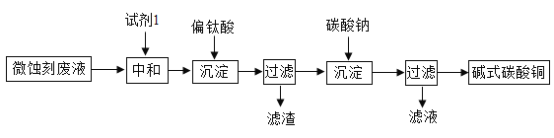
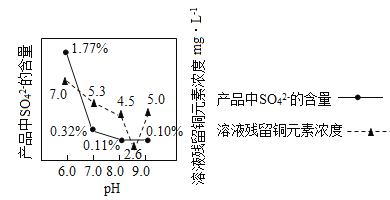
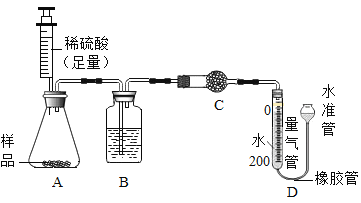

 CO(NH2)2 + H2O
CO(NH2)2 + H2O 测定 pH 值 B.
测定 pH 值 B.  点燃酒精灯
点燃酒精灯 取液时挤入空气 D.
取液时挤入空气 D.  稀释浓硫酸
稀释浓硫酸