题目内容
碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如下:
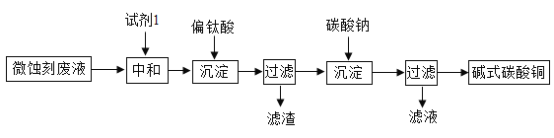
(1)加入试剂1的目的是除去废液中的酸性物质,试剂1最好选用__________(填序号)。
aFe2O3bCaCO3cCuO
(2)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,反应的化学方程式为:6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5__________ 。
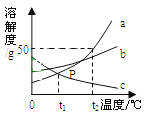
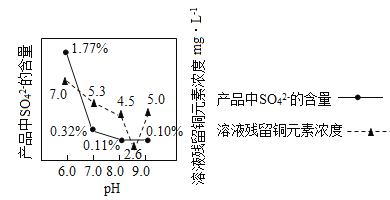
(3)加入Na2CO3沉淀时,反应液pH对产品中的SO42- 含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在_________。
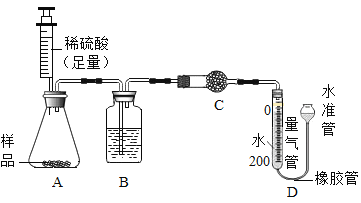
(4)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O。某研究小组设计如图实验装置测定其中CuCO3的质量分数(不考虑植物油中溶解CO2产生的影响)。
实验步骤如下:
a.连接装置并________;
b.准确称量样品的质量1.2g;
c.装药品,调节量气装置两边液面相平,读取量气管刻度为10mL;
d.向锥形瓶内加入50mL(足量)的稀硫酸,充分反应;
e.冷却到室温;
f.再次调节量气装置两边液面相平,读取量气管刻度为172mL。
①请将上述实验步骤补充完整;
②装置B的作用是 _________,C中的试剂是 _____________(填字母序号);
a碱石灰 b浓硫酸 c无水硫酸铜
③步骤f中调节液面相平的操作是将水准管 _____________(填“缓慢上移”或“缓慢下移”)。
④若标准状况下,每44g二氧化碳的体积为22.4L。根据实验数据计算产品中CuCO3的质量分数_______(写出计算过程。结果保留到0.1%)
⑤若其他操作均正确,仅因下列因素可使测定结果偏小的是_______________(填字母序号);
A量气管中未加植物油 B步骤c中平视刻度,步骤f中俯视读数
C硫酸的用量不足 D步骤f中没有调节量气装置两边液面相平,直接读数
某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的 ]。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
]。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
[提出问题]该瓶溶液中溶质的成分是什么?该瓶溶液中亚硫酸钠的质量分数是多少?
[查阅资料]
a、Na2SO3有较强还原性,在空气中易被氧气氧化: ;
;
b、Na2SO3能与酸反应产生SO2气体;
c、SO32-、SO42-均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
[作出猜想]
猜想1:没有变质,成分是Na2SO3;
猜想2:完全变质,成分是Na2SO4;
猜想3:部分变质,成分是Na2SO3和Na2SO4。
[实验探究I]甲组设计实验探究溶液是否变质:
甲组 | 实验操作 | 现象 | 结论 |
步骤1 | 取少量样品于试管中加入过量稀盐酸。 | 产生气泡 | 溶液中含有_____ |
步骤2 | _____ | _____ | 溶液中含有Na2SO4 |
实验结论是_____。
[实验探究Ⅱ]乙组设计如下实验测定Na2SO3溶液的溶质质量分数。
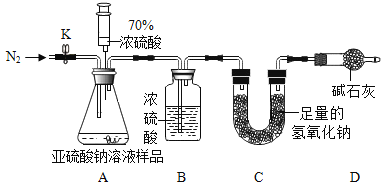
(1)连好装置并检查装置气密性,在锥形瓶中放人126g该样品,通入N2的目的是_____。
(2)实验前称量C装置的质量为128.8g。
(3)关闭活塞K,用注射器推入浓硫酸至不再产生气泡,注射器可以换为_____,也能控制液体试剂的滴加速率。
(4)打开活塞K,缓缓鼓入一定量的N2,继续通入N2的作用是_____。
(5)再次称量C装置的质量为135.2g。
(6)计算出该溶液中Na2SO3的质量分数为10%,若没有D装置,实验结果将_____(填“偏大”“不变”或“偏小”)。
[反思]由此可得出,保存亚硫酸钠时应_____。


 蒸发皿
蒸发皿 烧杯
烧杯 量筒
量筒 玻璃棒
玻璃棒 加水稀释氯化钠溶液
加水稀释氯化钠溶液 两份等质量的过氧化氢溶液在有、无MnO2的情况下分解产生氧气
两份等质量的过氧化氢溶液在有、无MnO2的情况下分解产生氧气 向稀盐酸和硫酸铜的混合溶液中加入氢氧化钠溶液
向稀盐酸和硫酸铜的混合溶液中加入氢氧化钠溶液 加热碳酸钙
加热碳酸钙