题目内容
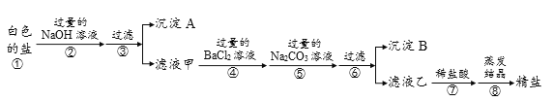
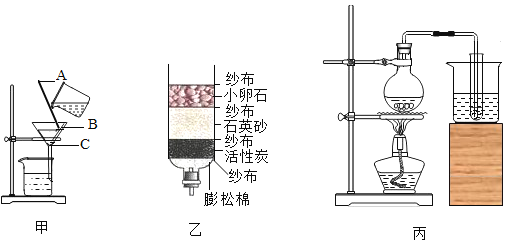
【题目】华为公司孟晚舟女士被加拿大应美国要求无端拘押后,引发国人愤怒。生产芯片的半导体材料有硅、锗、砷化镓等,应用比较广泛的是硅,华为在5G和芯片技术方面有自己新的突破。如图是工业上以石英砂(SiO2)为主要原料制取纯硅的方法,请回答以下问题:
(1)地壳中硅元素的含量仅次于_____元素(用符号表示)。
(2)写出反应①的化学方程式_____。焦炭在反应①中体现出来的化学性质是_____性,该反应中化合价升高的元素为_____(用符号表示)。
(3)反应②的基本反应类型是_____,HCl气体由_____构成(填“分子”“原子”或“离子”)。
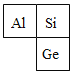
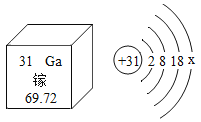
(4)硅和锗的组成元素在周期表中的位置如图所示,则两种元素属于同一_____(“周期”或“族”),两种元素中属于金属元素的为_____(用符号表示)。
(5)硅原子结构示意图为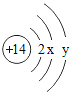 ,则y为_____,“14”表示_____。
,则y为_____,“14”表示_____。
(6)氮化镓(GaN)是第三代半导体材料,镓是一种奇妙的金属,放在手心马上熔化,犹如荷叶上的水珠流来流去。请阅读信息后回答:
①金属镓_____(填物理性质)。
②镓原子结构示意图中X的数值_____,镓的氧化物的化学式_____,请标出该氧化物中镓元素的化合价_____。
【答案】O ![]() 还原 C 置换反应 分子 族 Ge 4 硅原子核内有14个质子 熔点低 3 Ga2O3
还原 C 置换反应 分子 族 Ge 4 硅原子核内有14个质子 熔点低 3 Ga2O3 ![]()
【解析】
(1)地壳中含量最多的元素是O元素,其次是Si元素。
(2)反应①为石英砂(SiO2)与焦炭C的反应,反应的化学方程式为![]() ;反应中C元素的化合价升高,所以C在反应中体现出还原性;该反应中C的化合价升高,由0价变为+2价。
;反应中C元素的化合价升高,所以C在反应中体现出还原性;该反应中C的化合价升高,由0价变为+2价。
(3)反应②为SiCl4与H2反应生成Si单质和HCl,是一个置换反应;HCl气体由分子构成。
(4)硅和锗在同一列,是同一族的元素;两种元素中锗(Ge)属于金属元素。
(5)Si的结构示意图中,第一层有2个电子,第二层有8个电子,最外层有4个电子,则y=4;14表示Si原子的核电荷数为14,即Si原子核内有14个质子。
(6) ①手心的温度只有三十多度,金属镓放在手心马上熔化为液体,说明金属镓的熔点低。
②镓的核内质子数为31,所以核外电子数也为31,所以最外层电子数为31-2-8-18=3;
由最外层电子数可知镓的化合价为+3价,所以镓的氧化物的化学式为Ga2O3;
镓的化合价为+3价,表示为 ![]() 。
。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】水产养殖的速效增氧剂“鱼浮灵”的主要成分是过氧碳酸钠(![]() )。某化学研究小组对“鱼浮灵”的制备、成分测定及增氧原理进行了如下探究。
)。某化学研究小组对“鱼浮灵”的制备、成分测定及增氧原理进行了如下探究。
(查阅资料)①过氧碳酸钠有![]() 和
和![]() 的双重性质;50℃开始分解。
的双重性质;50℃开始分解。
②过氧碳酸钠在异丙醇(有机溶剂)中的溶解度较低。
Ⅰ.“鱼浮灵”的制备。
实验室用![]() 与稳定剂的混合溶液和30%的
与稳定剂的混合溶液和30%的![]() 溶液反应制备过氧碳酸钠,实验装置如图所示。
溶液反应制备过氧碳酸钠,实验装置如图所示。
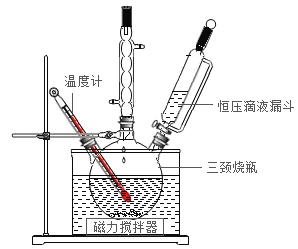
(1)反应温度不能超过20℃的原因是_____。
(2)反应结束后,停止搅拌,向反应液中加入异丙醇,静置过滤、洗涤、干燥,获得过氧碳酸钠固体。加入异丙醇的目的_____。
Ⅱ.“鱼浮灵”的成分测定。
(定性检测)检测过氧碳酸钠溶液中的成分。
(3)请补充完成下列实验报告中的相关内容。
实验序号 | 实验步骤 | 实验现象 | 解释或结论 |
① | 取样,加入 | 木条复燃 | 反应的化学方程式 _____ |
② | _____ | _____ | 溶液中含有 |
(定量研究)测定“鱼浮灵”中过氧碳酸钠的组成。
实验③:称取一定质量的“鱼浮灵”样品于小烧杯中,加适量水溶解,向小烧杯中加入足量![]() ,溶液,过滤、洗涤、干燥,得到碳酸钡(
,溶液,过滤、洗涤、干燥,得到碳酸钡(![]() )固体3.94g。
)固体3.94g。
实验④:另称取相同质量的“鱼浮灵”样品于锥形瓶中,加入足量稀硫酸,再逐滴加入高锰酸钾溶液,充分反应,消耗![]() 的质量为1.896g,该反应的原理是:
的质量为1.896g,该反应的原理是:
![]() 。
。
(4)计算确定过氧碳酸钠(![]() )的化学式_____(写出计算过程)。
)的化学式_____(写出计算过程)。
Ⅲ.“鱼浮灵”的增氧原理。
研究小组通过测定常温下相同时间内水溶液中溶解氧的变化,探究![]() 、
、![]() 对
对![]() 分解速率的影响,设计了对比实验,实验数据记录如下表。
分解速率的影响,设计了对比实验,实验数据记录如下表。
编号 | ① | ② | ③ | ④ | ⑤ |
试剂 |
|
|
|
|
|
pH | 6.96 | 6.01 | 8.14 | 8.15 | 9.26 |
溶解氧( | 5.68 | 6.44 | 9.11 | 9.12 | 10.97 |
(5)由实验②可知,常温下,过氧化氢水溶液呈_____(填“酸性”“中性”或“碱性”)。
(6)过氧碳酸钠可以速效增氧的原理是_____。