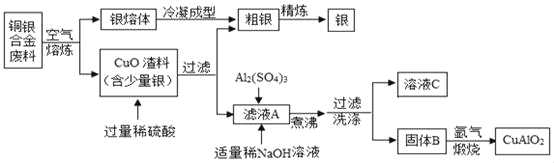
题目内容
【题目】在“粗盐中难溶性杂质的去除”的实验课上,同学们制得了“白色的盐”,小刚很高兴,并大声地说:“我制得了纯净的NaCl。”老师否定了他的说法,并解释说:“同学们制得的白色的盐中除了含有NaCl外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质。”于是,同学们为了得到更纯的NaCl,设计了如下的实验方案:
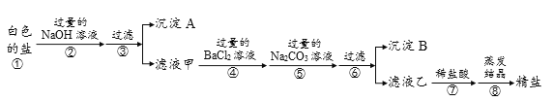
请回答下列问题:
(1)沉淀A的化学式是_________。
(2)若将步骤④和⑤顺序颠倒会引发的后果是_____________________。
(3)沉淀B中除了含有CaCO3以外还含有_______________。(填化学式)
(4)滤液乙中含有的阴离子是__________。(填离子称号)
(5)小刚向滤液乙中,滴入几滴稀盐酸后就进行蒸发操作。丽丽马上制止,并设计实验, 探究蒸发皿内溶液中除了NaCl以外,是否还含有其他溶质。于是,取少量该溶液于试管中,接下来进行的操作是______________,观察到的现象是___________________________________。
由此得出该溶液中溶质成分为NaCl和Na2CO3。如果用该溶液蒸发结晶,则得不到更纯的NaCl。
【答案】Mg(OH)2多余的钡离子无法除去BaCO3、BaSO4氯离子、氢氧根离子和碳酸根离子加入足量氯化钙溶液,静置后滴加酚酞试液产生白色沉淀,酚酞试液变红色
【解析】
正确的操作步骤为:(1)将粗盐溶于足量水中制成溶液;
(2)向溶液中加入足量的NaOH溶液,除去Mg2+,反应的方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl,过滤,除去滤渣;
(3)向上述溶液中加入足量的BaCl2溶液,除去SO42-,反应的化学方程式为:Na2SO4+BaCl2=BaSO4↓+2NaCl;
(4)向上述滤液中加入足量的Na2CO3溶液,除去Ca2+、Ba2+,反应的方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl,Na2CO3+BaCl2=BaCO3↓+2NaCl;
(5)向(4)滤液中滴加稀盐酸,调节PH=7,除去CO32-和OH-,反应的化学方程式为:Na2CO3+2HCl=H2O+CO2↑+2NaCl,NaOH+HCl=NaCl+H2O;
(6)将NaCl溶液蒸发,洗涤干燥,即得较纯净的食盐。
(1)氢氧化钠只与NaCl、MgCl2、CaCl2、Na2SO4中的MgCl2反应生成生成氢氧化镁白色沉淀和氯化钠,沉淀A的化学式是:Mg(OH)2;
(2) 氯化钡除去SO42-,碳酸钠除去Ca2+和前面过量的钡离子;加入的碳酸钠溶液应该放在氯化钡溶液之后,否则多余的钡离子无法除去;
(3) 根据分析中的除杂过程可知,沉淀B中除含碳酸钙、碳酸钡外还含有硫酸钡;
(4)根据分析中的除杂过程可知,滤液乙中所含的溶质除氯化钠外还含有碳酸钠和氢氧化钠,含有的阴离子是:氯离子、氢氧根离子和碳酸根离子;
(5) 因为滤液乙中所含的溶质除氯化钠外还含有氢氧化钠、碳酸钠;所以实验方案:取少量滤液于试管中,加入足量氯化钙溶液,产生白色沉淀,说明滤液中含有碳酸钠,静置后滴加酚酞试液,酚酞试液变红色,说明滤液中含有氢氧化钠。