题目内容
将一定量的石灰石放入烧杯中,加入一定量的稀盐酸,恰好完全反应,产生4.4g气体,反应后所得溶液的溶质的质量分数为20%.(杂质不溶于水,也不参与反应)计算:反应前稀盐酸的溶质的质量分数.(结果精确到0.1%)
14.6%
解析试题分析:设生成CaCl2的质量为x,石灰石中CaCO3的质量为y,参与反应的HCl的质量为z.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
y z x 4.4g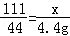
x=11.1g 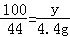
y="10" g 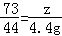
z=7.3g
所以反应后溶液的质量=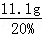 =55.5g
=55.5g
反应前稀盐酸的溶质的质量分数=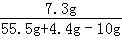 ×100%="14.6%"
×100%="14.6%"
答:反应前稀盐酸的溶质的质量分数为14.6%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:本考点考查了根据化学方程式的计算,属于质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律.本考点主要出现在计算题中.

练习册系列答案
相关题目